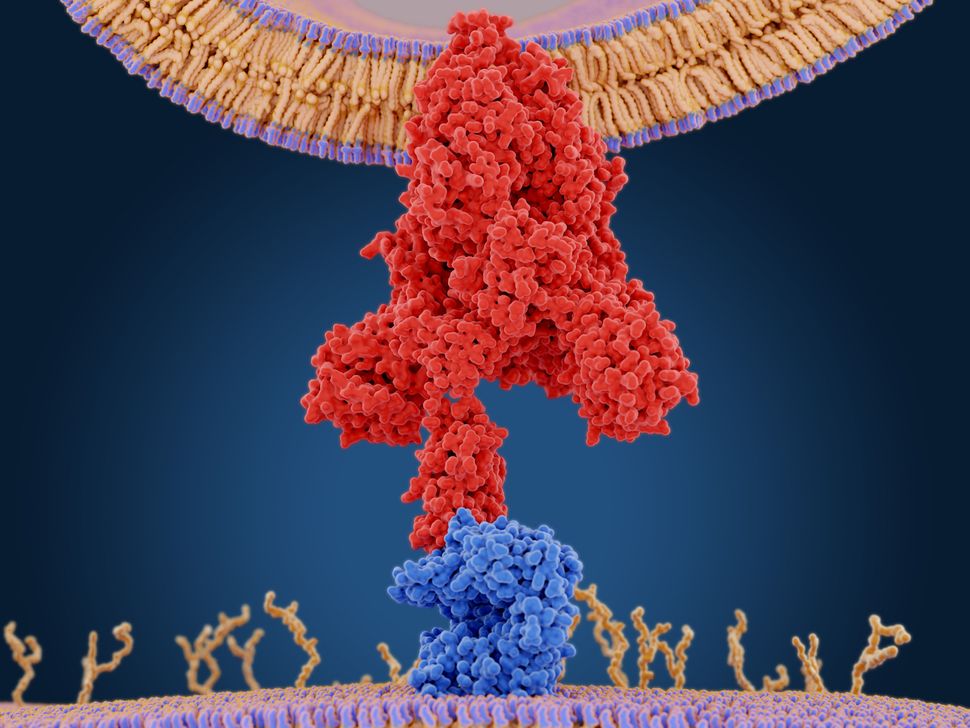
Sua “proteína de pico” é melhor na ligação às células do que a de vírus semelhantes.
A proteína que o coronavírus usa para anexar às células humanas tem uma “crista” compacta que permite que ela se ligue mais fortemente às células humanas do que vírus semelhantes, permitindo infectar melhor e se espalhar mais rapidamente, de acordo com um novo estudo.
O novo coronavírus, SARS-CoV-2, se liga às células humanas através do que é chamado de “proteína de pico”, de acordo com um relatório anterior da Live Science. Depois que a proteína spike se liga ao receptor celular humano – uma proteína na superfície celular que serve como porta para a célula – a membrana viral se funde com a membrana celular humana, permitindo que o genoma do vírus entre nas células humanas.
Todos os coronavírus se ligam às células humanas através de proteínas de pico, mas diferentes coronavírus têm proteínas de pico com estruturas diferentes. Em fevereiro, um grupo de pesquisadores da Universidade do Texas em Austin e do National Institutes of Health mapeou a estrutura molecular da nova proteína de pico do coronavírus, segundo o relatório.
Agora, outro grupo de pesquisadores usou raios-X para explorar ainda mais a proteína de pico do coronavírus e o receptor de células humanas ao qual se liga. Seu objetivo era entender por que a proteína de pico do coronavírus é tão boa em infectar células, em comparação com um coronavírus semelhante, conhecido como SARS-CoV, que causou o surto da síndrome respiratória aguda grave (SARS) em 2003.
O SARS-CoV e o SARS-CoV-2 se ligam ao mesmo receptor humano, conhecido como ACE2. Eles descobriram que algumas mutações genéticas levaram a proteína spike do SARS-CoV-2 a desenvolver uma “crista” molecular mais compacta do que a do SARS-CoV, de acordo com um comunicado da Universidade de Minnesota.
Essa estrutura mais compacta e várias outras pequenas diferenças permitem que o SARS-CoV-2 se ligue mais fortemente ao receptor ACE2 humano, permitindo assim infectar melhor as células e, assim, se espalhar mais rápido que o coronavírus SARS, de acordo com o comunicado.
“Em geral, aprendendo quais características estruturais das proteínas virais são mais importantes no estabelecimento de contato com células humanas, podemos projetar drogas que as busquem e bloqueiem sua atividade – como bloquear seu radar”, disse Fang Li, professor do Departamento de Ciências Veterinárias e Biomédicas da Universidade de Minnesota, disse no comunicado.
Ao estudar as especificidades desse vírus e como ele se liga às células, os pesquisadores também obtiveram algumas idéias sobre como o vírus pode ter saltado de animais para humanos.
Eles descobriram que um coronavírus de morcego também se liga ao receptor ACE2, mas mal. Algumas mutações poderiam ter aumentado a capacidade do vírus do morcego de se ligar ao receptor humano, permitindo o salto para os seres humanos, de acordo com o comunicado. Os pesquisadores também analisaram a estrutura das proteínas spike das pangolinas, que poderiam ser um hospedeiro intermediário entre morcegos e humanos, de acordo com um relatório anterior da Live Science.
Eles descobriram que um dos coronavírus de pangolim poderia potencialmente se ligar ao receptor humano, apoiando a noção de que as pangolinas eram hospedeiras intermediárias do vírus. Mas essa hipótese “precisaria ser verificada experimentalmente”, escreveram eles no estudo.
Publicado em 04/04/2020 17h32
Artigo original:
Estudo original:
Achou importante? Compartilhe!
Assine nossa newsletter e fique informado sobre Astrofísica, Biofísica, Geofísica e outras áreas. Preencha seu e-mail no espaço abaixo e clique em “OK”:




