
À medida que as bactérias resistentes aos antibióticos se tornam cada vez mais difíceis de derrotar, consultar aqueles que estiveram em batalha com nosso antigo inimigo muito antes de nós faz muito sentido.
Os vírus chamados bacteriófagos estão em conflito com as bactérias desde muito antes de existirmos. Assim, pesquisadores da Universidade da Califórnia, em San Diego, examinaram mais de perto alguns dos fagos jumbo menos estudados, especificamente o 201phi2-1, que infecta a bactéria Pseudomonas chlororaphis.
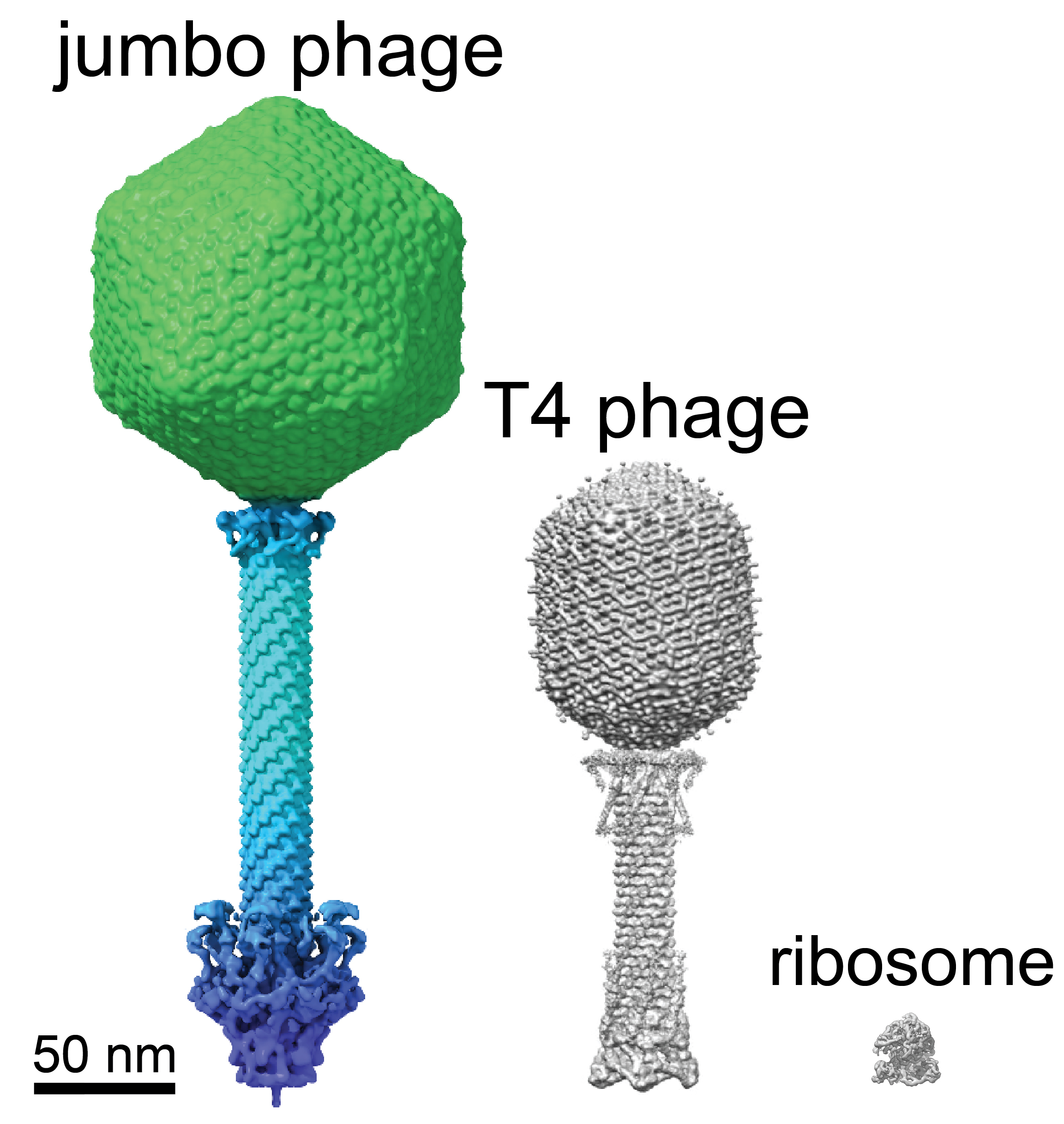
Nomeados por seus grandes genomas de mais de 200.000 pares de bases (a maioria dos fagos que infectam Pseudomonas tem genomas com menos de 100.000 pares de bases), os fagos jumbo têm um arsenal de técnicas para combater os mecanismos de defesa bacterianos. Pesquisas anteriores descobriram que o cultivo de um escudo em torno de seu material genético era uma dessas táticas, tornando o ciclo de vida desses vírus único.
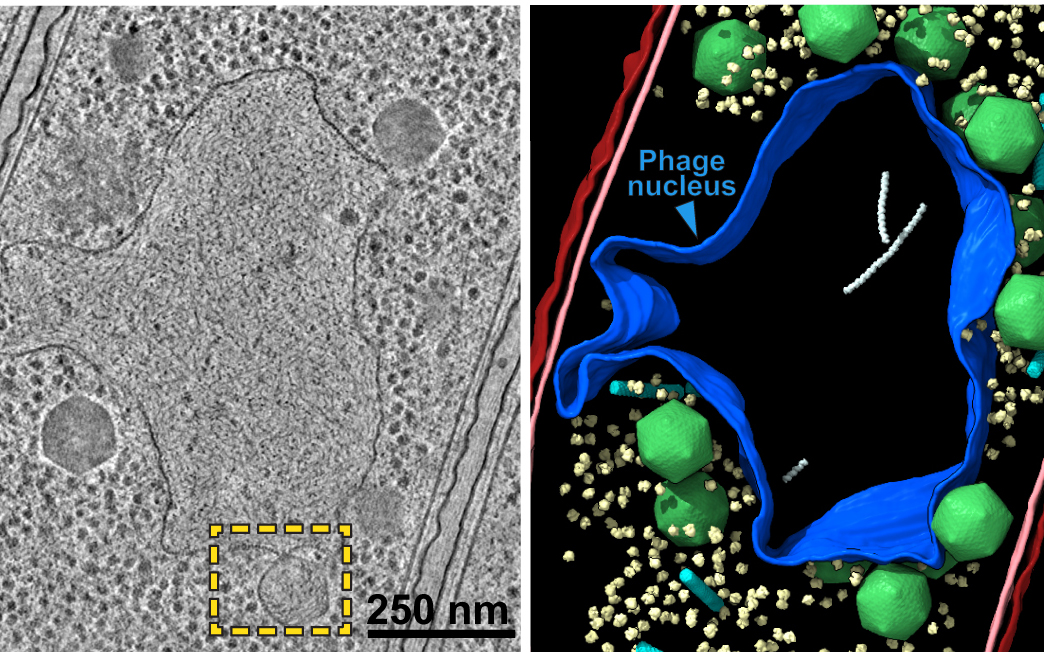
A separação do material genômico do restante do conteúdo da célula, envolvendo-o, ?era pensado anteriormente ter evoluído apenas uma vez na história da vida?, escrevem o biólogo molecular Thomas Laughlin e colegas em seu novo artigo. Mas acontece que esses minúsculos gigantes nos venceram.
?É um tipo diferente de compartimento – diferente de tudo que já vimos na natureza?, diz a biofísica Elizabeth Villa.
Normalmente, os fagos injetam seu material genético nas bactérias, onde flutua livremente na gosma interna da célula (citoplasma), enquanto o vírus sequestra o equipamento da bactéria para se replicar. Mas esses fagos gigantes constroem um compartimento de separação em torno de seu DNA logo após ele entrar em seu hospedeiro, um pouco como nossas células têm um núcleo para proteger nosso DNA.
Isso impede fisicamente o ‘sistema imunológico’ CRISPR da bactéria (sim, são os mesmos sistemas que nós humanos cooptamos para nossos próprios propósitos de manipulação de genes) e outras enzimas defensivas de mexer com o DNA viral.
Laughlin e sua equipe usaram microscopia crioeletrônica e tomografia para examinar esse compartimento até a escala atômica. O invólucro protetor foi construído a partir de apenas um único tipo de proteína, que os pesquisadores chamaram de chimallin, em homenagem a um antigo escudo asteca.
Com a ajuda da modelagem computacional, os pesquisadores descobriram que o núcleo do fago permite seletivamente que as moléculas passem por minúsculos poros – novamente semelhante à forma como as células controlam o ambiente ao redor do nosso material genético, tornando este um exemplo notável de evolução convergente – quando organismos completamente não relacionados acabam. com uma solução semelhante para o mesmo problema biológico.
“O poro nuclear em eucariotos é uma estrutura gigantesca e complexa com maneiras muito distintas de manter a maioria das proteínas fora, mas especificamente importar outras. O que provavelmente estamos vendo com o fago jumbo é um método dramaticamente mais simples de resolver o mesmo problema”, explica bioquímico Kevin Corbett. “É uma solução incrivelmente criativa – semelhante, mas mais simples – para proteger seu genoma do mundo exterior, construindo uma parede para separá-lo das defesas bacterianas”.
Incrivelmente, esse escudo também pode crescer à medida que o genoma do fago se replica. Os pesquisadores ainda não têm certeza de como os fagos gerenciam isso, mas suspeitam que o compartimento provavelmente esteja se abrindo para permitir que mais unidades de chimallina se juntem a ele, que são produzidas em abundância na infecção.
“Agora que sabemos que certos fagos têm um escudo, podemos dá-lo a outros fagos e fazer ‘superfagos’ que são melhores na terapia fágica e na superação das defesas bacterianas”, diz o biólogo celular Joe Pogliano.
“O primeiro passo nesse processo é entender a estrutura da proteína chimalina que compõe o escudo, que é uma das razões pelas quais este trabalho é tão importante.”
A terapia fágica já está sendo usada para tratar com sucesso pacientes com infecções por superbactérias. Também está sendo considerado para personalizar nossos microbiomas quando eles saem do controle.
Com essas cepas irritantes de bactérias se recusando a morrer, espera-se que matem 10 milhões de pessoas anualmente até 2050. Portanto, qualquer dica que possamos obter do inimigo de nosso inimigo para melhor nos defendermos não pode vir em breve.
Publicado em 13/08/2022 20h20
Artigo original:
Estudo original:


