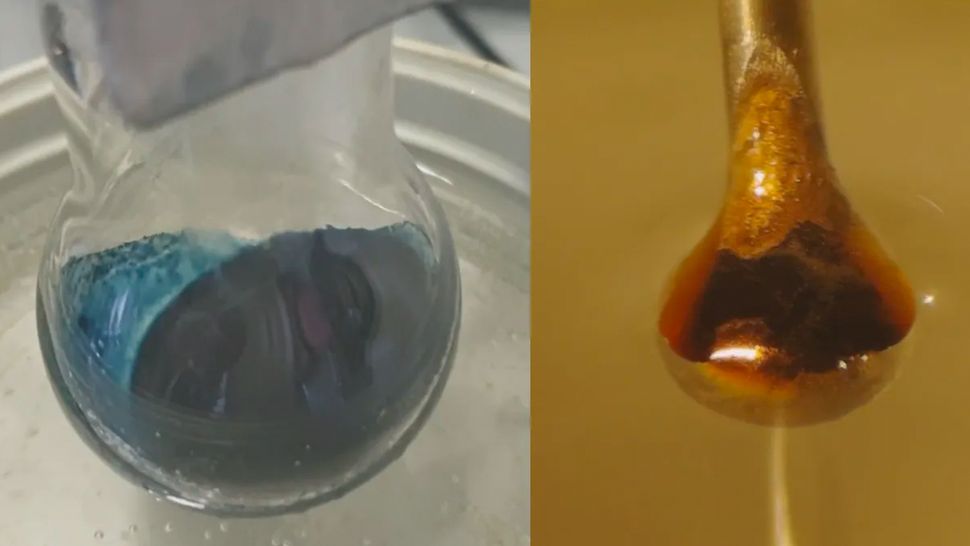
Os cientistas podem finalmente entender a misteriosa transição por trás de um experimento químico centenário. Os detalhes dessa transformação, na qual a adição de elétrons a uma solução de amônia azul brilhante a transforma em um bronze metálico brilhante, há muito tempo escapam aos cientistas.
O novo estudo revela os detalhes sutis dessa mudança e mostra que essa transformação é gradual, e não repentina. “O que fizemos com sucesso é que compreendemos como essas soluções se comportam em uma ampla gama de concentrações usando uma técnica de microjato”, disse o co-autor do estudo Ryan McMullen, doutorando em química na Universidade do Sul da Califórnia. . Essa técnica, que envolve disparar correntes finas da solução através do vácuo, nunca foi usada no líquido lustroso antes.
E a descoberta poderá abrir novos tipos de reações em química orgânica no futuro, disse McMullen à Live Science.
O que é um metal?
Os metais são um grupo diversificado. Alguns, como o lítio, são leves o suficiente para flutuar, enquanto outros, como chumbo ou ósmio, são extremamente densos. Alguns exigem temperaturas incrivelmente altas para derreter, enquanto outros derretem facilmente (Mercúrio, por exemplo, derrete a 38,3 graus Celsius negativos ou 37,9 graus Fahrenheit negativos). Por fim, o que os metais têm em comum é sua capacidade de conduzir eletricidade no zero absoluto, o ponto em que o movimento molecular do calor para essencialmente.
Mas como alguns não-metais se transformam em metais? Em um novo estudo, os pesquisadores responderam a essa pergunta adicionando metais à amônia líquida.
Primeiro, os pesquisadores condensaram a amônia, que é um gás à temperatura ambiente, em um líquido, resfriando-o para 27,4 F negativos (menos 33 C). Eles então adicionaram sódio, lítio ou potássio, que são todos metais alcalinos. (Famosamente, esses metais reagem explosivamente quando submersos na água.) Os experimentos foram realizados em colaboração com cientistas da Academia Tcheca de Ciências e do Instituto Fritz-Haber da Sociedade Max Planck em Berlim, além de pesquisadores do Japão e da França.
O resultado foi uma reação esperada: a amônia líquida puxou elétrons do metal. Esses elétrons ficaram presos entre as moléculas de amônia, criando os chamados elétrons solvatados que os pesquisadores esperavam estudar. Em baixas concentrações, o resultado foi um líquido azul não metálico. À medida que os elétrons solvatados ou presos se acumulavam, a solução passou para bronze brilhante.
O próximo desafio foi investigar como os elétrons solvatados se comportaram em diferentes concentrações. Isso envolveu fotografar um microjato da solução – da largura de um cabelo humano – através de um feixe de raios X síncrotron, que são feixes de raios X de alta energia. Os raios X excitaram os elétrons solvatados, fazendo com que pulassem para fora de sua gaiola líquida de moléculas de amônia. Os pesquisadores puderam medir a quantidade de energia necessária para liberar os elétrons solvatados.
Os pesquisadores descobriram que quanto maior a concentração de elétrons solvatados, mais o padrão de liberação de energia corresponde ao que é visto em um metal. Eis o que isso significa: se você representa graficamente a quantidade de energia necessária para liberar elétrons de sua gaiola de amônia líquida, os metais normalmente têm o que é chamado de “borda Fermi”, uma transição muito abrupta, disse McMullen. Em concentrações mais baixas de elétrons solvatados, este gráfico de liberação de energia se parece mais com uma colina arredondada. Somente em concentrações mais altas de elétrons essa borda de Fermi emergiu. O limite reflete a quantidade de energia que os elétrons têm em uma determinada temperatura, acrescentou McMullen.
“Quando você aumenta a concentração para a faixa metálica, percebe-se esse maravilhoso padrão que é muito, muito característico de um metal”, disse McMullen.
Os resultados foram interessantes porque mostraram que o líquido semelhante ao metal criado pela combinação de metais alcalinos e amônia é realmente um metal em um nível físico fundamental, disse ele.
“É um metal genuíno, não é algo que se pareça com um”, disse McMullen.
Os elétrons solvatados de baixa concentração são usados em um tipo de reação chamada reação de Birch, que adiciona elétrons às estruturas moleculares chamadas anéis aromáticos. Esse tipo de reação foi usado na fabricação das primeiras pílulas anticoncepcionais orais na década de 1950, disse McMullen. Ao entender como os elétrons solvatados funcionam em altas concentrações, os pesquisadores podem encontrar novos tipos de reações químicas, disse ele. Por exemplo, eles podem excitar os elétrons solvatados com feixes de luz para fazê-los se comportar de novas maneiras.
“Se você fizer cócegas nos elétrons um pouco para que eles fiquem mais animados energeticamente, poderá começar a observar algumas reações loucas que nunca aconteceriam”, disse McMullen.
Publicado em 02/07/2020 06h21
Artigo original:
Estudo original:
Achou importante? Compartilhe!
Assine nossa newsletter e fique informado sobre Astrofísica, Biofísica, Geofísica e outras áreas. Preencha seu e-mail no espaço abaixo e clique em “OK”:




