
Os glioblastomas são os tumores mais comuns e mortais do sistema nervoso central. O tratamento padrão para esses tumores geralmente envolve alguma combinação de cirurgia, radioterapia e quimioterapia, mas os pacientes ainda sobrevivem apenas alguns meses após o tratamento. Alguns medicamentos de imunoterapia mais recentes que se mostram promissores em outros tipos de câncer mostraram pouco ou nenhum benefício para pacientes com glioblastomas.
Em parte, isso ocorre porque as imunoterapias, que estimulam o sistema imunológico de uma pessoa para que ela possa combater o câncer, não atravessam bem a barreira hematoencefálica. Outro desafio é que os microambientes tumorais dos glioblastomas suprimem o sistema imunológico, tornando difícil para o sistema imunológico reconhecer e atacar as células cancerígenas.
Um estudo recente publicado na ACS Nano apresenta uma nova terapia combinada, investigada em camundongos, que pode abordar ambos os desafios. A terapia, quando combinada com uma explosão de radiação, interrompeu o crescimento do glioblastoma e prolongou a sobrevivência do camundongo.
“Superamos esses obstáculos usando vesículas extracelulares”, diz Bakhos Tannous, da Harvard Medical School. Tannous, autor sênior do artigo da ACS Nano, diz que as vesículas extracelulares (EVs) são “conhecidas por facilitar as comunicações intercelulares que governam diversos processos, como a resposta imune”.
EVs terapêuticos
Os EVs são naturalmente liberados de muitos tipos de células e carregam diferentes tipos de carga, como proteínas, ácidos nucleicos, lipídios e metabólitos, de uma célula-mãe. Com dezenas de nanômetros a quase 10 µm de tamanho, os menores EVs podem atravessar a barreira hematoencefálica e não são reconhecidos como invasores.
“Eles [EVs] são secretados naturalmente por todas as células do corpo e, portanto, não são moléculas estranhas que induzem a rejeição imunológica, como nanopartículas lipídicas sólidas, por exemplo”, diz Tannous, que também é diretor da Unidade Terapêutica Experimental e do Vetor Viral Central Facility no Massachusetts General Hospital.
Os usos terapêuticos dos EVs entraram em cena quando os pesquisadores perceberam que os EVs capturados em uma célula-alvo podem alterar seu comportamento. Desde essa descoberta, os pesquisadores demonstraram que os EVs podem ser usados como um veículo para distribuir drogas por todo o corpo.
Mas as terapias baseadas em EV por si só não são suficientes para tratar o glioblastoma, observa a equipe de Tannous.
Um freio indesejado
A radioterapia é talvez o tratamento não cirúrgico mais importante para o glioblastoma. Embora a radiação sensibilize tumores que não geram respostas de células T (que ajudam a matar células cancerosas), nem todas as respostas à radiação são benéficas. Às vezes, células imunes infiltrantes são recrutadas para um tumor em resposta à radiação. Essas células aumentam a quantidade de uma proteína crítica chamada PD-L1.
O PD-L1 é frequentemente descrito como um freio que mantém as respostas imunes do corpo sob controle. A expressão elevada de PD-L1 pode induzir o sistema imunológico do corpo a pensar que um tumor cancerígeno não é uma substância nociva e estranha. Como resultado, a terapia pode ser menos bem-sucedida do que na ausência de níveis elevados de PD-L1.
A equipe de Tannous introduziu uma imunoterapia combinada que inibe o PD-L1 e induz uma resposta imune no corpo para matar as células cancerígenas. Tannous e seus colaboradores, também baseados na Nanjing Medical University, na Universidade de Balamand e no Brigham and Women?s Hospital, introduziram pequenos ácidos ribonucleicos interferentes (siRNAs) em EVs para reverter o efeito anti-imunogênico que ocorre quando os tumores são preparados com radiação.
“Ao carregar EVs com siRNAs contra PD-L1 e injetá-los em camundongos portadores de tumores preparados com uma explosão de radiação, podemos reverter esse efeito e induzir a ativação de células T e imunidade antitumoral”, explica Tannous. “A explosão de radiação foi essencial não apenas no recrutamento de células imunes, mas também no aumento da absorção desses EVs pelo tumor e seu microambiente”.
Nova terapia combinada
A equipe produziu os EVs usando uma linhagem de células progenitoras neurais humanas e os modificou com um peptídeo (RGDyK cíclico) que tem como alvo tumores cerebrais e ajuda os EVs a penetrar na barreira hemato-tumor. Os pesquisadores então introduziram siRNAs nas membranas dos EVs para ajudar a garantir que o sistema imunológico do corpo responda ao tumor.
Os pesquisadores então testaram sua terapia combinada. Eles injetaram camundongos com linhas celulares de glioblastoma murino. Os tumores murinos foram preparados com uma explosão de 5 Gy de radiação, análoga à radiocirurgia estereotáxica em um ambiente clínico, sete e 14 dias após a injeção de células tumorais. Os camundongos receberam uma injeção da terapia combinada, EVs não modificados ou solução salina (como controle) nos dias 10, 12, 17 e 19 após a injeção de células tumorais.
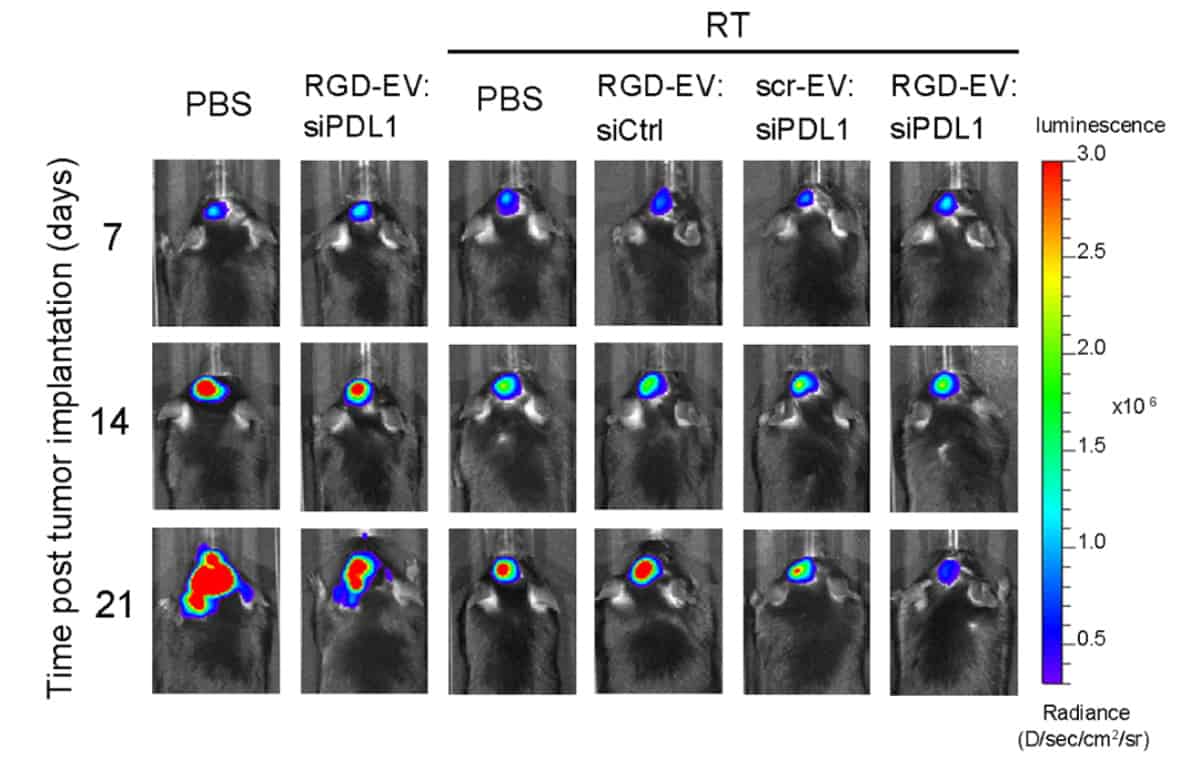
A equipe descobriu que preparar os tumores de glioblastoma murino com uma explosão de radiação melhorou a entrega de EVs aos tumores. A terapia de combinação também interrompeu o crescimento do tumor e prolongou a sobrevivência do camundongo. Os resultados sugerem ainda que o uso de EVs permitiu que a imunoterapia cruzasse a barreira hematoencefálica/tumor, recrutando células imunes para o local do tumor e inibindo a expressão de PD-L1. Estudos de imagem de fluorescência mostraram que sinais de fluorescência mais fortes e, portanto, mais EVs, foram observados em cérebros de camundongos que foram irradiados em relação aos que não foram.
Produção em larga escala
Os pesquisadores dizem que sua decisão de isolar EVs de uma linhagem de células progenitoras neurais humanas, em vez de células-tronco ou células dendríticas, foi importante. O uso de uma linha celular progenitora neural humana permite que eles produzam EVs em quantidades maiores para estudos e ensaios clínicos maiores.
Outra decisão importante foi usar a química de clique sem cobre para modificar os EVs para incluir o peptídeo direcionado ao tumor cerebral na superfície do EV. A química de clique sem cobre, ao contrário de alguns métodos de engenharia celular, é adequada para aplicações in vivo, é rápida e pode ser usada para produção em larga escala de EVs modificados. Trabalhos anteriores do grupo não encontraram toxicidade óbvia ou danos nos tecidos usando esses métodos.
Agora, a equipe de Tannous está ampliando a produção e rotulagem de veículos elétricos. Os pesquisadores também estão trabalhando para melhorar ainda mais o sistema de entrega de EVs e estão testando como os EVs podem fornecer terapias de ácido nucleico para tumores cerebrais.
Publicado em 08/03/2022 22h01
Artigo original:
Estudo original:


