
“Eletrodos vivos” feitos de células nervosas geneticamente modificadas para responder à luz foram implantados com sucesso no cérebro dos animais. A esperança é que eles forneçam uma maneira melhor e mais duradoura de conectar cérebros a computadores do que os eletrodos convencionais.
“Isso permite que nossa tecnologia fale a linguagem do sistema nervoso, em vez de choques elétricos, que é o que é feito agora”, diz Kacy Cullen, da Universidade da Pensilvânia. “Quando nossos neurônios implantados são ativados, a parte mais profunda do cérebro à qual eles estão conectados torna-se ativada por um mecanismo sináptico natural.”.
O próximo implante cerebral é um fio vivo real
Chega de metal: eletrodos vivos prometem maneiras melhores e mais seguras de consertar ferimentos e doenças e desenvolver novas ligações entre o homem e a máquina.
Os neurovisionários sonham em um dia fundir nossos cérebros aos computadores. Essa era parece mais próxima do que nunca: pioneiros da tecnologia como Elon Musk e Mark Zuckerberg estão agora buscando implantes cerebrais que não são apenas para tratamento, mas poderiam nos permitir fazer coisas como comunicar-nos telepaticamente ou digitar com nossas mentes. Outros afirmam que em breve teremos neuropróteses para melhorar nossa atenção e memória, ou permitir-nos integrar nossos cérebros com a Internet e controlar nossas casas inteligentes com nossas mentes.
Implantes elétricos simples têm sido usados desde a década de 1980 para estimulação cerebral profunda (DBS), em que eletrodos de arame penetrando no cérebro liberam pulsos de corrente elétrica para aliviar os sintomas da doença de Parkinson, transtorno obsessivo-compulsivo e outros problemas neurológicos. Mais raras, mas também em uso, são as terapias de implante cerebral para pessoas paralisadas por lesão na medula espinhal ou outros danos neurológicos. Um chip inserido no cérebro lê sinais elétricos que são traduzidos por um computador para restaurar algum movimento e comunicação. Mas essas configurações de interface cérebro-computador (BCI) são tão complexas que até agora só foram usadas em algumas dezenas de casos.
A verdade é que o hardware ainda não está lá. Os implantes têm grandes desvantagens. Eles exigem cirurgia para remover um pedaço de crânio. E os eletrodos de metal que penetram no cérebro eventualmente causam a formação de tecido cicatricial. “É semelhante a uma lasca que você colocaria sob a pele”, diz Kevin Otto, um bioengenheiro da Universidade da Flórida que constrói interfaces neurais. Eles também podem se desgastar e se mover e, como resultado, não funcionam tão bem. Menos comumente, podem causar complicações mais sérias, como infecção, sangramento e derrame. Esses riscos limitaram o uso de DBS para pacientes que não respondem à medicação e BCIs para aqueles que perderam funções corporais importantes.
Para que o futuro imaginado pelos Musks e Zuckerbergs do mundo aconteça, os cientistas devem encontrar maneiras de acessar o cérebro de uma forma menos invasiva. Uma possibilidade: fazer eletrodos de tecido vivo em vez de arame. Kacy Cullen, professora associada de neurocirurgia da Universidade da Pensilvânia, está tentando fazer exatamente isso.

Cullen usa engenharia de tecidos para fazer crescer minúsculos fios tridimensionais de células cerebrais que ele chama de “eletrodos vivos”. Cultivados a partir de células-tronco e depois embalados em tubos de gel biodegradáveis, esses eletrodos naturais podem ser mais suaves no cérebro, fundindo-se e conectando-se com o tecido vivo em vez de feri-lo. Ele espera que eles possam resolver alguns dos problemas com implantes usados em DBS e BCIs e, potencialmente, tornar esses tratamentos disponíveis para mais pacientes.
“Esta é uma interface orgânica que realmente permite que você fale a linguagem do cérebro – com o benefício adicional de ser auto-renovável, já que é uma entidade viva”, diz ele. Eletrodos vivos podem não apenas substituir os eletrodos tradicionais, mas também restaurar o “conectoma”, as conexões de longa distância que podem esticar e romper durante a lesão cerebral ou definhar devido a doenças como Parkinson ou epilepsia.
Em última análise, um BCI mais orgânico também poderia ser usado para entender melhor o cérebro, como ao estudar os estados mentais das pessoas – embora ele acredite que essas aplicações ainda estejam a pelo menos uma década.
Como fazer crescer um eletrodo
Para fazer os eletrodos vivos, Cullen e sua equipe começam com células-tronco pluripotentes induzidas, que são geradas por meio de engenharia genética a partir de células adultas e têm potencial para se transformar em qualquer tipo de célula do corpo. Em seguida, eles induzem as células-tronco a se transformarem em diferentes tipos de neurônios com longos axônios, as fibras nervosas que transportam mensagens entre as células nervosas.

Os axônios são essenciais para as conexões complexas que permitem que o cérebro funcione. Trilhões de axônios cruzam o cérebro, constituindo cerca de 60% dele, a parte conhecida como matéria branca. Essas pequenas fibras são delicadas e, se forem rasgadas ou quebradas, não voltarão a crescer. “Quando essas vias sucumbem a um trauma, acidente vascular cerebral ou doença neurodegenerativa, não há realmente nenhum mecanismo para fazê-las crescer novamente”, diz Cullen.
“Eles estão basicamente perdidos para sempre.”
Em seu laboratório, os axônios crescem em filamentos tridimensionais densos até terem cerca de um centímetro de comprimento e a largura de um cabelo humano. Em seguida, esses longos tratos de axônio são embalados em tubos de polímero biodegradáveis. O resultado é um eletrodo vivo. Uma extremidade, onde os corpos celulares dos neurônios estão agrupados, é projetada para ficar na superfície do cérebro enquanto a outra extremidade pode ser injetada em um ponto preciso no cérebro. Os tubos em forma de gel em que os tratos são embalados eventualmente se dissolvem no cérebro, deixando para trás os axônios vivos.
A equipe já implantou esses eletrodos da bioengenharia em mais de 60 ratos até agora, onde eles sobrevivem por pelo menos um mês e mantêm sua estrutura. Eles também veem evidências de que os neurônios normais de ratos e os eletrodos implantados estão tentando se comunicar uns com os outros. Pequenas projeções de crescimento chamadas neurites se formam nas extremidades injetadas dos eletrodos, e a equipe também viu evidências de que as sinapses, as estruturas especializadas que os neurônios usam para trocar informações, estão se formando.
Cullen e sua equipe foram capazes de usar os eletrodos vivos para registrar a atividade cerebral em ratos, sugerindo que a informação que eles coletam com tal sistema pode um dia ser enviada para um computador e usada com um BCI.
“A ideia de colocar um eletrodo vivo – algo que é biologicamente ativo, responsivo e vivo por si só” abre a possibilidade de que um sistema BCI ou DBS possa durar muito mais tempo, diz Otto.
Melhor estimulação cerebral
Cullen acha que DBS é uma aplicação de curto prazo para seus eletrodos biológicos. Os estimuladores atuais fornecem esses choques de uma maneira ampla, enviando eletricidade por todas as seções do cérebro. Mas neurônios diferentes fazem coisas diferentes, então Cullen quer usar seus eletrodos vivos para atingir tipos específicos de neurônios, adaptando DBS mais precisamente para certas doenças.
Em um artigo publicado no servidor de pré-impressão bioRxiv no início deste ano, ele e sua equipe descrevem como eles criaram geneticamente certos neurônios dentro dos eletrodos vivos para serem sensíveis à luz. Eles então removeram um pedaço de crânio de ratos e injetaram eletrodos sensíveis à luz em seus cérebros. Eles usaram um dispositivo com LEDs que fica na superfície do cérebro para emitir luz em certos comprimentos de onda para atingir tipos específicos de neurônios – uma abordagem conhecida como optogenética.
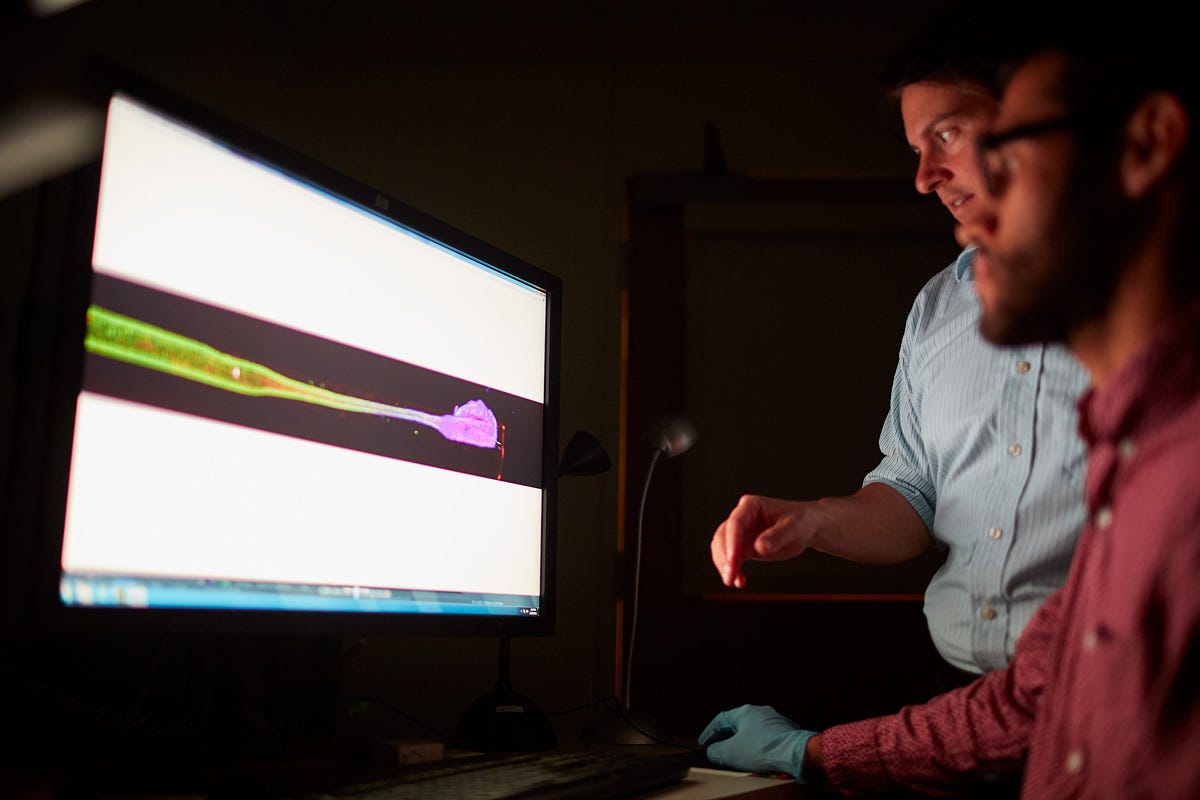
O dispositivo LED foi capaz de estimular apenas neurônios selecionados conectados aos fios de axônio implantados, sugerindo que poderia ser usado como um tipo mais específico de DBS. Nenhuma terapia optogenética está disponível ainda, e o primeiro ensaio clínico para testar tal tratamento ainda está em andamento.
Inicialmente, um sistema como este só pode ser útil perto da superfície do cérebro, diz Kim Burchiel, um cirurgião DBS na Oregon Health and Sciences University. O DBS para a doença de Parkinson requer eletrodos de três a oito centímetros de comprimento, mas Cullen e sua equipe até agora só conseguiram aumentar seus eletrodos vivos para cerca de dois centímetros. As aplicações do cérebro na superfície podem incluir uma interface para restaurar a visão ou a audição, que são processadas principalmente no córtex, a camada externa do cérebro. O sistema também pode ser usado com um estimulador para prevenir a epilepsia, já que as convulsões começam no córtex.
“Esta é uma interface orgânica que realmente permite que você fale a linguagem do cérebro.”
Por que se dar ao trabalho de ter esse sistema biológico mais complicado quando o DBS se tornou rotina para o Parkinson? Cullen diz que sua abordagem poderia realmente restaurar as vias do axônio que produzem dopamina, a substância química que diminui no cérebro de pessoas com Parkinson, em vez de apenas mitigar os efeitos da perda de dopamina. E ele acha que esses eletrodos criam novas possibilidades para o DBS ser usado no tratamento de outras doenças. “Eu acho que, à medida que as aplicações de estimulação cerebral profunda convencional continuam a expandir nossa terapia, podemos ter um apoio potencial”, diz Cullen. Ainda assim, seria necessária uma cirurgia no cérebro, então os pesquisadores precisarão ter certeza de que o risco de abrir o crânio vale o benefício da terapia.
Por enquanto, Cullen está trabalhando em uma meta mais atingível. Ele acha que apenas os fios do axônio podem estar prontos para testes em humanos em quatro a cinco anos. Estes podem ser injetados diretamente no cérebro para reparar as vias cerebrais que podem ter sucumbido a lesão cerebral traumática, bem como doenças neurodegenerativas como o Parkinson. Cullen abriu uma empresa, chamada Innervace, para comercializar essa abordagem.
Primeiro, ele terá que se certificar de que os eletrodos vivos estão seguros nas pessoas e não são rejeitados pelo sistema imunológico do corpo, que tem sido um obstáculo para mover células-tronco pluripotentes para testes clínicos em humanos.
Burchiel diz que uma interface biológica entre o cérebro e um computador externo ou estimulador seria um “sistema ideal”, mas ele acha que é algo que levará mais algumas décadas para se desenvolver. Mesmo assim, ele acha que esses sistemas serão usados apenas para fins médicos, especialmente se ainda precisarem de cirurgia cerebral.
“Essa ideia é muito atraente”, diz ele. “Mas eu não acredito que todos nós vamos nos transformar em um bando de ciborgues.”
Publicado em 16/11/2020 10h03
Artigo original:
Estudo original:
Achou importante? Compartilhe!
Assine nossa newsletter e fique informado sobre Astrofísica, Biofísica, Geofísica e outras áreas. Preencha seu e-mail no espaço abaixo e clique em “OK”:




