
Os cientistas estão começando a descobrir como o microbioma intestinal pode afetar a saúde do cérebro. Isso pode levar a tratamentos melhores e mais fáceis para doenças cerebrais.
Em 2006, logo depois de lançar seu próprio laboratório, a neurocientista Jane Foster descobriu algo que ela tinha certeza que deixaria seu campo em movimento. Ela e sua equipe estavam trabalhando com dois grupos de camundongos: um com uma seleção saudável de microrganismos nas entranhas e outro sem microbioma. Eles notaram que os ratos sem bactérias intestinais pareciam menos ansiosos do que seus equivalentes saudáveis. Quando colocados em um labirinto com alguns caminhos abertos e alguns com paredes, eles preferiram os caminhos expostos. A bactéria no intestino parecia estar influenciando seu cérebro e comportamento.
Foster, da Universidade McMaster em Toronto, Canadá, redigiu o estudo e o enviou para publicação. Foi rejeitado. Ela o reescreveu e o enviou novamente. Rejeitado. “As pessoas não compravam. Eles pensaram que era um artefato”, diz ela. Finalmente, após três anos e sete submissões, ela recebeu uma carta de aceitação.
John Cryan, neurocientista da University College Cork, na Irlanda, ingressou na área na mesma época que Foster e sabe exatamente como ela se sentiu. Quando ele começou a falar sobre as conexões entre as bactérias que vivem no intestino e no cérebro, “me senti muito evangélico”, diz ele. Ele se lembra de uma conferência sobre a doença de Alzheimer que apresentou em 2014. “Nunca fiz uma palestra em uma sala onde houvesse menos interesse.”
Hoje, porém, o eixo intestino-cérebro é uma característica nas principais reuniões de neurociência, e Cryan diz que não é mais “esse cara maluco da Irlanda”. Milhares de publicações na última década revelaram que os trilhões de bactérias no intestino podem ter efeitos profundos no cérebro e podem estar ligados a uma série de distúrbios. Financiadores como o Instituto Nacional de Saúde dos EUA estão investindo milhões de dólares para explorar a conexão.
Mas junto com essa explosão de interesse veio o hype. Alguns pesquisadores do cérebro e intestino afirmam ou sugerem relações causais quando muitos estudos mostram apenas correlações, e alguns instáveis, diz Maureen O?Malley, uma filósofa da Universidade de Sydney, na Austrália, que estuda o campo da pesquisa de microbioma. “Você encontrou uma causa real ou encontrou apenas outro efeito?”
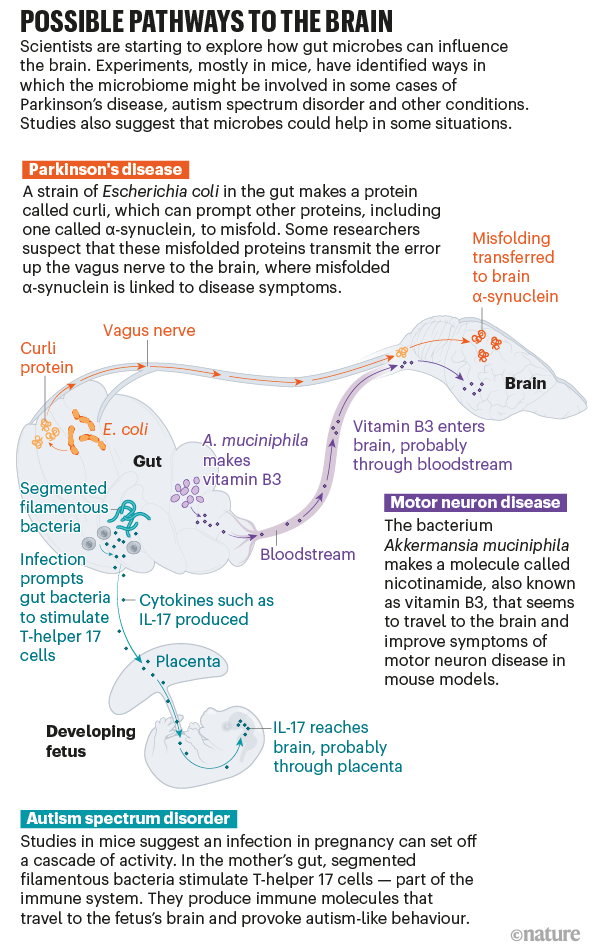
Nos últimos anos, no entanto, o campo fez avanços significativos, diz O’Malley. Em vez de falar sobre o microbioma como um todo, algumas equipes de pesquisa começaram a fazer pesquisas para identificar micróbios específicos, mapeando as vias complexas e às vezes surpreendentes que os conectam ao cérebro. “Isso é o que permite que atribuições causais sejam feitas”, diz ela. Estudos em ratos – e trabalhos preliminares em humanos – sugerem que os micróbios podem desencadear ou alterar o curso de condições como a doença de Parkinson, transtorno do espectro do autismo e muito mais (consulte ?Possíveis vias para o cérebro?). Terapias destinadas a ajustar o microbioma podem ajudar a prevenir ou tratar essas doenças, uma ideia que alguns pesquisadores e empresas já estão testando em testes clínicos em humanos.
Ainda é cedo, mas a perspectiva de novas terapias para algumas dessas doenças cerebrais intratáveis é empolgante, diz Sarkis Mazmanian, microbiologista do Instituto de Tecnologia da Califórnia em Pasadena – principalmente considerando como é muito mais fácil manipular o intestino do que o cérebro . Fazer terapias no cérebro tem sido um desafio de longa data, diz ele, “mas você pode com certeza mudar o microbioma”.
Transmissão emaranhado
Em 1817, o cirurgião inglês James Parkinson descreveu alguns dos primeiros casos de “paralisia dos tremores” que viriam a ser conhecidos como doença de Parkinson. Um indivíduo desenvolveu dormência e sensação de formigamento em ambos os braços. Parkinson notou que o abdômen do homem parecia conter “considerável acúmulo”. Ele administrou um laxante ao homem e, dez dias depois, seus intestinos estavam vazios e os sintomas desapareceram.
Parkinson pode ter descoberto algo. Algumas pessoas que desenvolvem a doença apresentam constipação muito antes de desenvolverem problemas de mobilidade. E muitos pesquisadores abraçaram a ideia de que a doença começa no intestino, pelo menos em alguns casos.
Para entender a ideia, é útil saber um pouco sobre a doença. Os sintomas característicos do Parkinson – tremores, rigidez e lentidão de movimento – aparecem quando os neurônios responsáveis pela coordenação do movimento começam a morrer. Por que esses neurônios morrem não é totalmente compreendido, mas uma proteína conhecida como ?-sinucleína parece ter um papel fundamental. Em pessoas com doença de Parkinson, a proteína se desdobra. A primeira proteína mal dobrada faz com que mais proteínas sejam mal dobradas, até que aglomerados nocivos conhecidos como corpos de Lewy comecem a se formar no cérebro.
O que desencadeia essa cascata? Em 2015, Robert Friedland, neurologista da Universidade de Louisville em Kentucky, propôs uma nova teoria. Ele havia lido que as bactérias intestinais podem produzir proteínas que têm uma estrutura semelhante às proteínas ?-sinucleína deformadas, então ele postulou que as proteínas bacterianas podem estar fornecendo um modelo para o dobramento incorreto. E quando ele e seus colegas alimentaram ratos com uma cepa particular de Escherichia coli que produz uma dessas proteínas de aglutinação, chamada curli, no intestino, eles viram mais acúmulo de ?-sinucleína no cérebro dos animais. Trabalho publicado no ano passado por Mazmanian e sua equipe apóia a teoria de Friedland.
Ainda não está claro como esse sinal no intestino chega ao cérebro, mas um canal provável é o nervo vago. O vago conecta o tronco cerebral a muitos órgãos, incluindo o cólon, tornando-o o mais longo dos doze nervos cranianos que transportam sinais entre o cérebro e o resto do corpo. “É realmente uma rodovia”, diz Cryan. E pesquisas em humanos e animais sugerem que ele tem um papel crucial em transportar pelo menos algumas mensagens entre o intestino e o cérebro.
Na década de 1970, uma terapia comum para úlceras estomacais era remover todo ou parte do nervo para conter a produção de ácido no estômago. Mas, nas últimas décadas, os pesquisadores notaram um efeito colateral estranho: as pessoas que haviam se submetido a esse procedimento pareciam menos suscetíveis à doença de Parkinson.
Em um estudo em camundongos, a injeção de ?-sinucleína mal dobrada no intestino a produziu no cérebro. Mas se os pesquisadores removeram primeiro o nervo vago, nenhuma ?-sinucleína apareceu no cérebro. A própria ?-sinucleína injetada parece permanecer no intestino, mas Valina Dawson, neurocientista da Universidade Johns Hopkins em Baltimore, Maryland, que foi autora do estudo, acha que pode haver um efeito dominó: proteínas mal dobradas transmitem o erro pelo nervo vago até que as proteínas do cérebro acabem se dobrando incorretamente. Mazmanian e seus colegas agora estão conduzindo experimentos para ver se a proteína curli no intestino ainda pode induzir os sintomas de Parkinson em camundongos que tiveram o nervo vago cortado.
Como as proteínas mal dobradas são uma marca registrada de várias outras condições que afetam o cérebro, incluindo a doença de Alzheimer e a doença do neurônio motor (esclerose lateral amiotrófica ou ELA), Friedland afirma que as proteínas bacterianas também podem estar implicadas nessas doenças. Dawson acha a ideia plausível, mas diz que as amilóides bacterianas não são o único fator a ser considerado. O mal de Parkinson, por exemplo, é uma doença complexa que se apresenta de maneira diferente em pessoas diferentes. Ainda assim, ela diz, “esta pode ser uma maneira de começar”.
Declínio acelerado
Os defensores da ligação intestino-cérebro dizem que o microbioma pode fazer mais do que apenas desencadear alguns casos de doenças neurodegenerativas: ele também pode ter efeitos sobre sua gravidade. Eran Elinav, imunologista do Instituto Weizmann de Ciência em Rehovot, Israel, e do Centro Alemão de Pesquisa do Câncer em Heidelberg, ficou impressionado com as diferenças em como a ELA pode se desenvolver: algumas pessoas com a doença progridem lentamente e outras se deterioram rapidamente. Elinav se perguntou se o microbioma ajudaria a explicar essas diferenças, então ele e sua equipe começaram a trabalhar com um dos modelos mais comuns de ratos ALS. Quando eles eliminaram o microbioma com antibióticos ou usaram camundongos sem microbioma desde o nascimento, observaram uma progressão muito mais rápida da doença do que em camundongos com um microbioma normal7.
A equipe comparou bactérias intestinais em camundongos ALS com as de seus irmãos saudáveis e encontrou várias espécies microbianas que pareciam estar ligadas a doenças. Eles transplantaram meticulosamente essas espécies, uma por uma, em outro grupo de camundongos sem nenhuma bactéria intestinal, identificando duas espécies que pioraram os sintomas de ELA e uma que parecia melhorá-los. “E então nos perguntamos: ‘como essa cepa que vive apenas no intestino causa um impacto tão surpreendente em uma doença que está focada no cérebro?'”, Diz Elinav.
Os culpados podem ser metabólitos bacterianos – pequenas moléculas produzidas por bactérias que podem entrar na corrente sanguínea e viajar pelo corpo. Pelo menos metade de todas as pequenas moléculas no sangue são “feitas por micróbios ou moduladas por micróbios”, diz Elinav. Ele e sua equipe analisaram os metabólitos produzidos pelo micróbio benéfico e administraram um, uma molécula chamada nicotinamida – também conhecida como vitamina B3 – a camundongos com tendência à ELA. Eles descobriram que a molécula entrou no cérebro e melhorou seus sintomas. “Poderíamos provar que existe uma bactéria, poderíamos provar que existe um produto da bactéria e poderíamos provar que estava nadando para o órgão-alvo certo e fazendo algo favorável ao curso da doença”, diz ele.
Quando compararam os microbiomas de pessoas com ALS e os de seus familiares não afetados, eles viram menos nicotinamida nos indivíduos com ALS. O metabólito está prontamente disponível como suplemento, e Elinav diz que ele e seus colegas estão planejando um ensaio clínico com ele.
Pelo menos um grupo já testou a vitamina B3 como tratamento para ALS em um pequeno ensaio, embora seja uma versão combinada com outro composto. Eles administraram a participantes com ALS por quatro meses. Aqueles no grupo de tratamento mostraram alguma melhora, mas quase todas as pessoas no grupo de placebo tiveram problemas de saúde.
“Este é apenas o começo”, diz Elinav. Existem muito mais bactérias e metabólitos, e todas as células do corpo estão abertas aos seus efeitos. Depois de perceber isso, diz ele, “você começa a entender que o efeito do microbioma pode se expandir muito além de onde os micróbios vivem de fato”.
Efeitos geracionais
O efeito pode até mesmo passar de uma geração para a outra. Veja o transtorno do espectro do autismo (ASD). As causas ainda são pouco conhecidas, mas infecções em uma mãe durante a gravidez parecem aumentar o risco de TEA em seu filho, de acordo com estudos epidemiológicos. Por exemplo, em uma coorte sueca de quase 1,8 milhão de pessoas, aquelas cujas mães foram hospitalizadas por qualquer infecção durante a gravidez tiveram um risco 79% maior de serem diagnosticadas com TEA9.
A pesquisa em ratos também apóia o link. Para simular uma infecção, os pesquisadores injetam em camundongos grávidas RNA de fita dupla, que o corpo vê como um invasor viral. Seus filhotes exibem mais comportamentos repetitivos e ansiedade do que aqueles nascidos de mães que não foram injetadas e interagem menos com outros ratos – sintomas que refletem aqueles de pessoas com TEA.
Gloria Choi, neurocientista do Instituto Picower de Aprendizagem e Memória do Massachusetts Institute of Technology em Cambridge, e seu marido e colaborador Jun Huh, imunologista da Harvard Medical School em Boston, queriam saber por quê. Eles se concentraram em um tipo de célula que se defende contra bactérias e fungos, produzindo moléculas chamadas citocinas. Quando Choi e Huh imitaram uma infecção em seus camundongos, essas células, chamadas células T-helper 17, tornaram-se hiperativas, produzindo um tipo particular de citocina chamada IL-17. Essa molécula viajou para o cérebro dos filhotes em desenvolvimento, provavelmente através da placenta, e depois se ligou aos receptores cerebrais. Isso pareceu ter um efeito profundo nos animais: os pesquisadores descobriram que a prole adulta apresentou aumento da atividade neural, o que causou seu comportamento semelhante ao autismo.
Mas “nem toda mulher grávida que é infectada ou hospitalizada durante a gravidez tem necessariamente filhos com distúrbios do neurodesenvolvimento ou autismo”, diz Huh. Deve haver algo inclinando o sistema imunológico da mãe para este estado hiperativo. Choi e Huh se concentraram em uma coleção de micróbios intestinais longos e delgados, conhecidos como bactérias filamentosas segmentadas, que já haviam demonstrado promover a formação de células T auxiliares 17. Quando eles trataram camundongos prenhes com um antibiótico para matar essas bactérias e, em seguida, estimularam uma resposta imunológica, os filhotes não desenvolveram nenhuma diferença comportamental.
Choi e Huh, ansiosos para saber se a pandemia de coronavírus poderia levar a um aumento do risco de ASD, estão coletando amostras de mulheres grávidas infectadas com SARS-CoV-2 e catalogando a bactéria em seus intestinos e os níveis de IL-17 em seus sangue. Dado que o coronavírus, como qualquer outra infecção, ativa o sistema imunológico da mãe, é plausível que o SARS-CoV-2 possa aumentar o risco de desenvolvimento alterado do cérebro e distúrbios potencialmente psiquiátricos, diz David Amaral, que estuda o ASD na Universidade da Califórnia, Davis. Os pesquisadores ainda não encontraram evidências que sustentem essa teoria.
Mauro Costa-Mattioli, neurobiologista do Baylor College of Medicine em Houston, Texas, também está estudando a relação entre bactérias e ASD. Mas em vez de olhar para os micróbios que causam o distúrbio, ele encontrou um que pode tratar seus sintomas.
Costa-Mattioli descobriu essa bactéria por acidente há cerca de cinco anos. Na época, ele estava trabalhando em ratos com descendentes que apresentavam sintomas semelhantes aos do autismo. Quando esses ratos foram alojados com outros neurotípicos (e comeram seus excrementos, como todos os ratos costumam fazer), seus comportamentos semelhantes ao ASD desapareceram. Costa-Mattioli e seus colegas descobriram que os ratos afetados não tinham uma espécie particular de bactéria: Lactobacillus reuteri.
Eles testaram o L. reuteri em vários outros modelos de camundongos, e a bactéria foi capaz de reverter alguns dos comportamentos semelhantes ao ASD em cada um. E, assim como com o trabalho do Parkinson, os pesquisadores poderiam bloquear o efeito em ratos se cortassem o nervo vago.
Exatamente que tipo de sinal L. reuteri envia ainda não é conhecido. A equipe descobriu que algumas cepas de L. reuteri podem reverter o comportamento, enquanto outras não, e os pesquisadores agora estão trabalhando para descobrir quais de seus genes estão envolvidos. Se encontrarem o gene que produz um metabólito-chave, “podemos simplesmente colocá-lo em qualquer bactéria e agora podemos ter um tratamento potencial”, diz Costa-Mattioli. Essa estratégia ainda não foi testada.
Um grupo na Itália já está testando L. reuteri como terapia em 80 crianças com ASD. Os participantes tomarão L. reuteri ou um comprimido de placebo por seis meses e terão seus sintomas monitorados. Costa-Mattioli espera lançar seu próprio teste em breve.
Resta saber se funcionará, mas Kevin Mitchell, neurogeneticista do Trinity College Dublin, ainda não considera os estudos com ratos convincentes. E vê a discussão do potencial terapêutico como prematura e “um pouco irresponsável”, diz ele, dada a complexidade do quadro.
Enquanto isso, os pesquisadores estão explorando mais doenças cerebrais, incluindo doença de Alzheimer e depressão. Os micróbios intestinais podem até influenciar a forma como o cérebro se recupera após a lesão. Corinne Benakis, neurobiologista do Instituto de Pesquisa de Derrame e Demência da Universidade Ludwig Maximilians de Munique, na Alemanha, e seus colegas trataram ratos com antibióticos para eliminar algumas bactérias intestinais antes de induzir um derrame. Eles descobriram que os antibióticos podem reduzir a gravidade dos danos cerebrais.
Em cada uma dessas doenças, muitas questões mecanicistas permanecem. Pesquisadores da área reconhecem que ainda precisam desenvolver os caminhos do micróbio ao cérebro. E a etapa mais complicada será validar essas descobertas em animais em humanos e iniciar os testes. “Essas são alegações extraordinárias, que devem exigir evidências extraordinárias”, diz Mitchell.
Mas também há um enorme interesse – e não apenas dos acadêmicos. Em fevereiro de 2019, a Axial Therapeutics em Waltham, Massachusetts, uma empresa cofundada por Mazmanian para desenvolver terapias para doenças neurodegenerativas e neuropsiquiátricas, arrecadou US $ 25 milhões em financiamento. Outra empresa, a Finch Therapeutics em Somerville, Massachusetts, que está desenvolvendo uma droga de microbioma oral para ASD, anunciou em setembro que arrecadou US $ 90 milhões.
Cryan viu os dados se acumularem desde que sua palestra sobre o assunto foi recebida com um silêncio pétreo. Ele considera as evidências de montagem convincentes e vê uma enorme promessa em terapias baseadas em microbioma. “Ao contrário do seu genoma, sobre o qual você não pode fazer muito exceto culpar seus pais e avós, seu microbioma é potencialmente modificável. E isso dá grande agência aos pacientes”, diz ele. “Isso é realmente emocionante.”
Publicado em 04/02/2021 18h30
Artigo original:
Estudo original:


