Créditos:Imagem: Fotografia de fundo cortesia dos pesquisadores. Editado por MIT News.
O peptídeo é usado por leguminosas para controlar bactérias fixadoras de nitrogênio; também pode oferecer pistas para o tratamento de pacientes com excesso de heme no sangue.
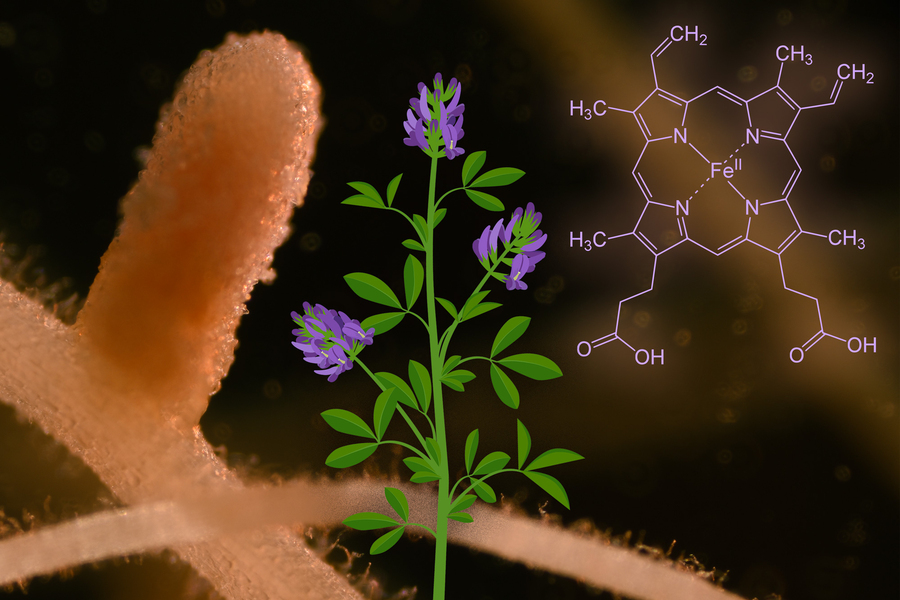
As relações simbióticas entre as leguminosas e as bactérias que crescem em suas raízes são críticas para a sobrevivência das plantas. Sem essas bactérias, as plantas não teriam fonte de nitrogênio, elemento essencial para a formação de proteínas e outras biomoléculas, e ficariam dependentes do fertilizante nitrogenado do solo.
Para estabelecer essa simbiose, algumas plantas leguminosas produzem centenas de peptídeos que ajudam as bactérias a viver dentro de estruturas conhecidas como nódulos dentro de suas raízes. Um novo estudo do MIT revela que um desses peptídeos tem uma função inesperada: ele absorve todo o heme disponível, uma molécula que contém ferro. Isso envia as bactérias para um modo de fome de ferro que aumenta sua produção de amônia, a forma de nitrogênio que é utilizável pelas plantas.
“Este é o primeiro dos 700 peptídeos neste sistema para o qual um mecanismo molecular realmente detalhado foi elaborado”, diz Graham Walker, professor de Biologia da American Cancer Society Research no MIT, professor do Howard Hughes Medical Institute e sênior autor do estudo.
Este peptídeo sequestrador de heme pode ter usos benéficos no tratamento de uma variedade de doenças humanas, dizem os pesquisadores. A remoção de heme livre do sangue pode ajudar a tratar doenças causadas por bactérias ou parasitas que precisam de heme para sobreviver, como P. gingivalis (doença periodontal) ou toxoplasmose, ou doenças como anemia falciforme ou sepse que liberam muito heme no corrente sanguínea.
“Este estudo demonstra que a pesquisa básica em interações planta-micróbio também tem potencial para ser traduzida em aplicações terapêuticas”, diz Siva Sankari, pesquisador do MIT e principal autor do estudo, publicado hoje na Nature Microbiology.
Outros autores do artigo incluem Vignesh Babu, pesquisador do MIT; Kevin Bian e Mary Andorfer, ambos pós-doutorandos do MIT; Areej Alhazmi, ex-bolsista KACST-MIT Ibn Khaldun para mulheres sauditas; Kwan Yoon e Dante Avalos, estudantes de pós-graduação do MIT; Tyler Smith, instrutor de biologia do MIT; Catherine Drennan, professora de química e biologia do MIT e investigadora do Howard Hughes Medical Institute; Michael Yaffe, professor de ciências David H. Koch e membro do Koch Institute for Integrative Cancer Research do MIT; e Sebastian Lourido, o Professor de Desenvolvimento de Carreira da Família Latham de Biologia no MIT e membro do Instituto Whitehead de Pesquisa Biomédica.
Controle de ferro
Por quase 40 anos, o laboratório de Walker estuda a simbiose entre leguminosas e rizóbios, um tipo de bactéria fixadora de nitrogênio. Essas bactérias convertem gás nitrogênio em amônia, uma etapa crítica do ciclo do nitrogênio da Terra que torna o elemento disponível para as plantas (e para os animais que comem as plantas).
A maior parte do trabalho de Walker se concentrou em uma planta parecida com um trevo chamada Medicago truncatula. As bactérias fixadoras de nitrogênio provocam a formação de nódulos nas raízes dessas plantas e, eventualmente, acabam dentro das células vegetais, onde se convertem em sua forma simbiótica chamada bacteroides.
Vários anos atrás, biólogos de plantas descobriram que Medicago truncatula produz cerca de 700 peptídeos que contribuem para a formação desses bacteróides. Esses peptídeos são gerados em ondas que ajudam as bactérias fazendo a transição de viver livremente para se incorporarem às células vegetais, onde atuam como máquinas de fixação de nitrogênio.
Walker e seus alunos escolheram um desses peptídeos, conhecido como NCR247, para investigar mais profundamente. Estudos iniciais revelaram que, quando as bactérias fixadoras de nitrogênio foram expostas a esse peptídeo, 15% de seus genes foram afetados. Muitos dos genes que se tornaram mais ativos estavam envolvidos na importação de ferro.
Os pesquisadores então descobriram que, quando fundiram NCR247 a uma proteína maior, a proteína híbrida ficou inesperadamente de cor avermelhada. Essa observação fortuita levou à descoberta de que o NCR247 se liga ao heme, uma molécula orgânica em forma de anel contendo ferro que é um componente importante da hemoglobina, a proteína que os glóbulos vermelhos usam para transportar oxigênio.
Outros estudos revelaram que quando o NCR247 é liberado nas células bacterianas, ele sequestra a maior parte do heme na célula, enviando as células para um modo de fome de ferro que as desencadeia a começar a importar mais ferro do ambiente externo.
“Geralmente as bactérias ajustam seu metabolismo de ferro e não absorvem mais ferro quando já há o suficiente”, diz Sankari. “O que é legal sobre esse peptídeo é que ele substitui esse mecanismo e regula indiretamente o teor de ferro das bactérias”.
A nitrogenase, a principal enzima que as bactérias usam para fixar nitrogênio, requer de 24 a 32 átomos de ferro por molécula de enzima, então o influxo de ferro extra provavelmente ajuda essas enzimas a se tornarem mais ativas, dizem os pesquisadores. Esse influxo é programado para coincidir com a fixação de nitrogênio, eles descobriram.
“Esses peptídeos são produzidos em onda nos nódulos, e a produção desse peptídeo específico é maior quando as bactérias estão se preparando para fixar nitrogênio. Se esse peptídeo fosse secretado durante todo o processo, a célula teria muito ferro o tempo todo, o que é ruim para a célula”, diz Sankari.
Sem o peptídeo NCR247, Medicago truncatula e rhizobium não podem formar uma simbiose efetiva de fixação de nitrogênio, mostraram os pesquisadores.
“Muitas direções possíveis”
O peptídeo que os pesquisadores estudaram neste trabalho pode ter potenciais usos terapêuticos. Quando o heme é incorporado à hemoglobina, ele desempenha uma função crítica no corpo, mas quando está solto na corrente sanguínea, pode matar células e promover inflamação. O heme livre pode se acumular no sangue armazenado, portanto, ter uma maneira de filtrar o heme antes que o sangue seja transfundido em um paciente pode ser potencialmente útil.
Uma variedade de doenças humanas leva à circulação do heme livre na corrente sanguínea, incluindo anemia falciforme, sepse e malária. Além disso, alguns parasitas e bactérias infecciosos dependem do heme para sua sobrevivência, mas não podem produzi-lo, então o eliminam do ambiente. O tratamento dessas infecções com uma proteína que absorve todo o heme disponível pode ajudar a impedir que as células parasitas ou bacterianas possam crescer e se reproduzir.
Neste estudo, Lourido e membros de seu laboratório mostraram que o tratamento do parasita Toxoplasma gondii com NCR427 impediu que o parasita formasse placas nas células humanas.
Os pesquisadores estão agora buscando colaborações com outros laboratórios do MIT para explorar algumas dessas aplicações potenciais, com financiamento do Professor Amar G. Bose Research Grant.
“Há muitas direções possíveis, mas todas estão em um estágio muito inicial”, diz Walker. “O número de aplicações clínicas potenciais é muito amplo. Você pode fazer mais de uma aposta neste jogo, o que é uma coisa intrigante.”
Atualmente, a proteína humana hemopexina, que também se liga ao heme, está sendo explorada como um possível tratamento para a anemia falciforme. O peptídeo NCR247 pode fornecer uma alternativa mais fácil de implantar, dizem os pesquisadores, porque é muito menor e pode ser mais fácil de fabricar e entregar ao corpo.
A pesquisa foi financiada em parte pelo MIT Center for Environmental Health Sciences, National Science Foundation e National Institutes of Health.
Publicado em 22/08/2022 12h58
Artigo original:
Estudo original:


