Os biólogos estão descobrindo como minúsculos cronômetros em nossas células podem controlar o tamanho do corpo, a expectativa de vida e o envelhecimento.
Em seu laboratório em Barcelona, ??Espanha, Miki Ebisuya construiu um relógio sem engrenagens, molas ou números. Este relógio não bate. É feito de genes e proteínas e mantém o tempo em uma camada de células que a equipe de Ebisuya desenvolveu em seu laboratório. Este relógio biológico é minúsculo, mas pode ajudar a explicar algumas das diferenças mais evidentes entre as espécies animais.
As células animais fervilham de atividade e o ritmo varia entre as espécies. Em todos os casos observados, as células de camundongos funcionam mais rápido do que as células humanas, que funcionam mais rápido do que as células de baleia. Essas diferenças afetam o tamanho de um animal, como suas partes são organizadas e talvez até por quanto tempo ele viverá. Mas os biólogos há muito se perguntam quais cronômetros celulares controlam essas velocidades e por que elas variam.
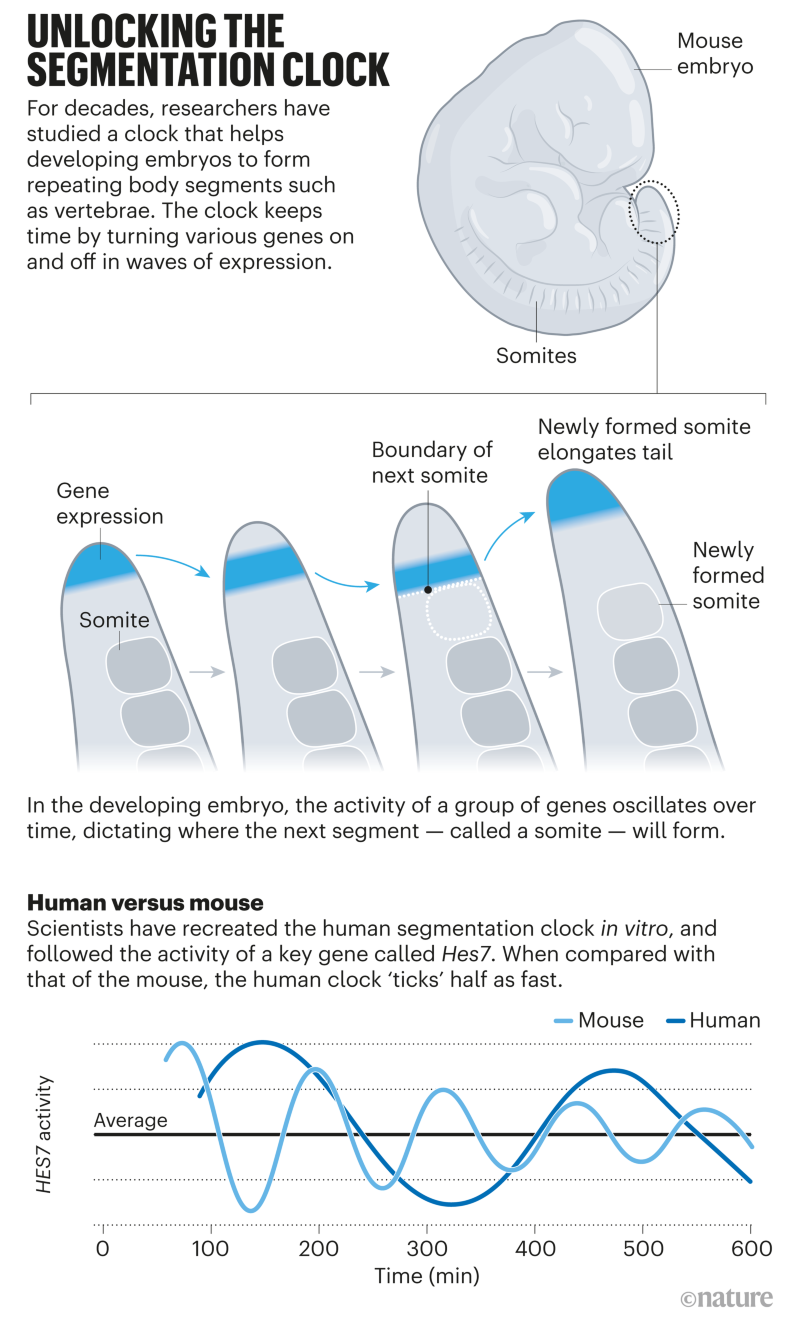
Uma onda de pesquisas está começando a produzir respostas para um dos muitos relógios que controlam o funcionamento das células. Há um relógio nos embriões iniciais que bate em um ritmo regular ativando e desativando genes. Este “relógio de segmentação” cria segmentos corporais repetidos, como as vértebras em nossas espinhas. Este é o relógio que Ebisuya fez em seu laboratório.
“Estou interessado no tempo biológico”, diz Ebisuya, biólogo do desenvolvimento do Laboratório Europeu de Biologia Molecular de Barcelona. “Mas o tempo de vida ou o período de gestação são muito longos para eu estudar.” A velocidade rápida do relógio de segmentação o torna um sistema de modelo ideal, diz ela.
Os biólogos têm estudado o relógio de segmentação desde a década de 1990 e sabem que ele funciona duas vezes mais rápido em embriões de camundongos do que em embriões humanos. A velocidade com que um embrião se desenvolve, ou com que diferentes partes dele se desenvolvem, tem uma influência importante no corpo adulto. Ebisuya e outros querem entender como as diferenças no ritmo de desenvolvimento dão origem a organismos com corpos e comportamentos tão diferentes.
Nos últimos três anos, as respostas começaram a surgir. Isso ocorre principalmente porque os biólogos agora podem cultivar o tecido que gera o relógio de segmentação in vitro, a partir de células-tronco humanas, e observar sua atividade em detalhes.
“O que é realmente empolgante aqui é que você pode assistir em [tecido] humano”, diz a bióloga de células-tronco Helen Blau, da Universidade de Stanford, na Califórnia. “É um grande avanço.”
As descobertas já estão derrubando algumas suposições antigas sobre como os diferentes animais se desenvolvem. Até agora, não há sinal de um gene mestre controlando a velocidade do relógio de segmentação. Em vez disso, sua velocidade parece ser controlada pelas diferentes taxas de decomposição das proteínas. Os cientistas presumiram que a velocidade era quase sempre constante para cada proteína nos animais, de modo que a descoberta pode exigir que revisem alguns livros de biologia molecular.
Essas diferenças na velocidade celular podem até ajudar a explicar características únicas do desenvolvimento humano, como nossos cérebros superdimensionados, infâncias prolongadas e vidas longas, em relação a muitas outras espécies.
Se os resultados dos estudos do relógio de segmentação forem verdadeiros, este minúsculo e fugaz relógio pode ajudar a revelar a existência de princípios bioquímicos mais profundos que moldam todas as nossas vidas.
Haeckel e heterocronia
A velocidade é importante quando se trata de construir espécies. A evolução não deu às girafas pescoços longos ao adicionar ossos extras; eles têm o mesmo número de vértebras que seus parentes ocapi de pescoço atarracado. Em vez disso, as vértebras do pescoço nas girafas crescem por longos períodos de tempo, o que lhes permite atingir tamanhos maiores.
Essa variação na velocidade com que diferentes partes do corpo se desenvolvem é chamada de heterocronia, um conceito descrito por Ernst Haeckel, um zoólogo alemão conhecido por seu trabalho sobre o desenvolvimento de embriões. Os biólogos do desenvolvimento modernos consideram a heterocronia um conceito-chave que ajuda a explicar um mistério central: nos primeiros estágios de desenvolvimento, todos os embriões de vertebrados se parecem, mas à medida que os embriões se desenvolvem, eles se tornam facilmente reconhecíveis. Como as células de um embrião humano se desenvolvem em um bebê humano, e não em um chimpanzé infantil ou peixe jovem?
Uma grande parte da resposta é que a velocidade com que as partes do corpo se desenvolvem faz uma grande diferença na aparência do animal final. Mas o que controla a velocidade do desenvolvimento?
Como Haeckel, os biólogos modernos descobriram que as vértebras e outros segmentos corporais repetidos são úteis como estudos de caso sobre como a velocidade do desenvolvimento molda os animais. Décadas atrás, eles começaram a investigar como os segmentos corporais surgem durante a embriogênese.
À medida que um embrião se desenvolve, um de seus compartimentos se divide em segmentos repetidos conhecidos como somitos, que vão da cabeça à cauda. Cada somito dá origem a uma única vértebra e seu tecido associado.
Em 1976, dois pesquisadores propuseram que as células desse compartimento poderiam conter, cada uma, um mecanismo oscilatório de algum tipo, que se liga e desliga em um ciclo repetitivo, controlando a produção de somitos1. “Isso permaneceu como uma curiosidade por algum tempo”, diz Olivier Pourquié, biólogo do desenvolvimento da Harvard Medical School em Boston, Massachusetts. “E então, no final da década de 1990, identificamos um gene que apresentava um comportamento rítmico no tecido que vai formar o somito.”
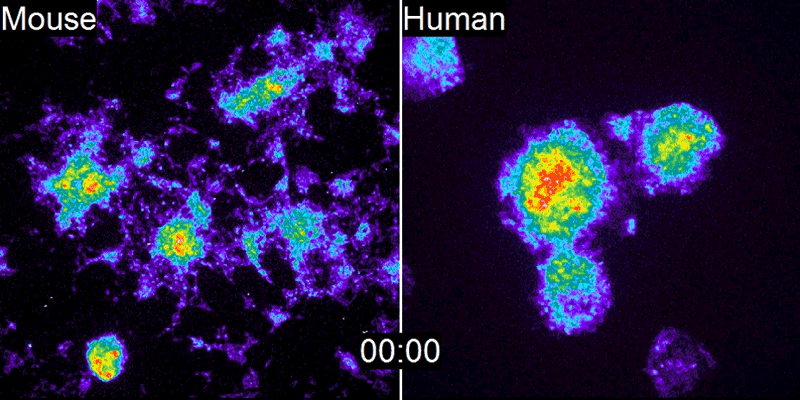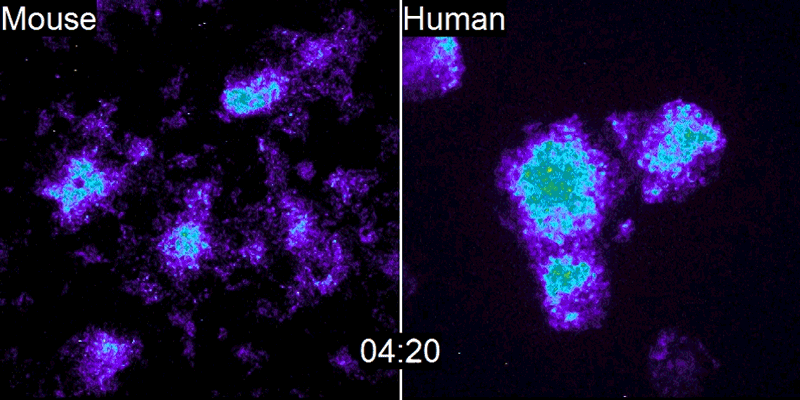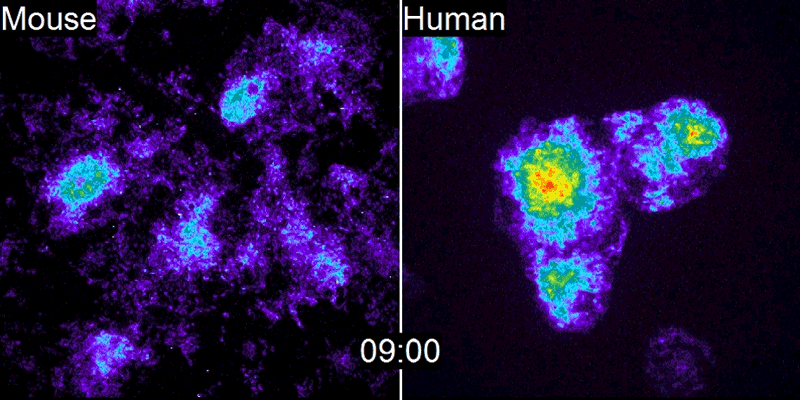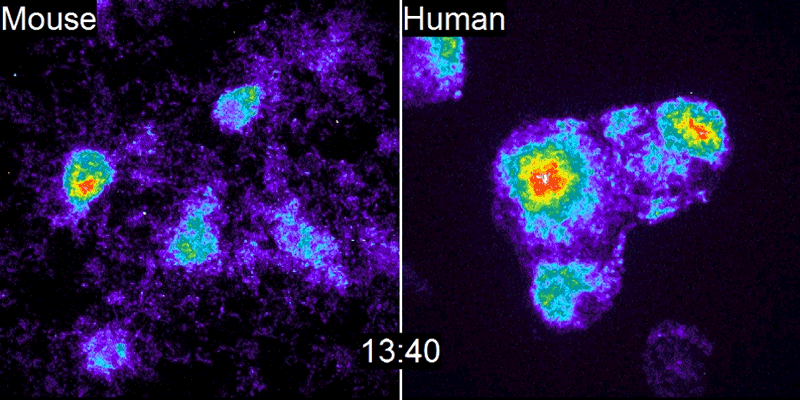
A equipe de Pourquié estudou o desenvolvimento de embriões de galinha e descobriu que um gene chamado c-hairy1 era ativado e desativado a cada 90 minutos2 – o tempo que leva para um somito se formar. Ondas de expressão de c-hairy1 moveram-se ao longo do embrião da cauda à cabeça, oscilando em sincronia com o desenvolvimento dos somitos. Desde então, relógios de segmentação semelhantes foram encontrados em camundongos e outras espécies.
Desde então, Pourquié e outros biólogos vêm tentando desmontar o relógio de segmentação e entender como ele funciona, construindo uma longa lista de genes e proteínas que ajudam o relógio a marcar o tempo. Um gene-chave é o Hes7, o equivalente mamífero do gene c-hairy1 das aves. Hes7 pode se ligar e desligar repetidamente, assim como vários outros genes envolvidos no relógio. Isso o torna “um marca-passo chave para o relógio de segmentação”, diz Ryoichiro Kageyama, biólogo do desenvolvimento da Universidade de Kyoto, no Japão, que estuda o gene há quase duas décadas.
Mas ainda não está claro por que o Hes7 liga e desliga em velocidades diferentes em espécies diferentes e, portanto, como a velocidade do relógio de segmentação é finalmente controlada. Uma série de estudos nos últimos três anos apontam para uma resposta.
Desmarcando o relógio
Em 2019 e 2020, vários laboratórios mostraram que podem recriar o relógio de segmentação humana in vitro, cultivando células-tronco para que se desenvolvam em tecido formador de somito 3-5. Esta foi a primeira evidência concreta de que os humanos têm um relógio de segmentação – embora isso fosse amplamente esperado. Mais importante, criar o relógio in vitro significava que ele poderia ser estudado em tecido humano pela primeira vez e permitiu uma análise muito mais detalhada de seu mecanismo.
Esses estudos foram possíveis devido aos avanços no cultivo de células-tronco para persuadi-las a crescer em tecidos específicos, diz Pierre Vanderhaeghen, neurobiologista do desenvolvimento da Universidade de Leuven, na Bélgica. Em embriões humanos, o relógio de segmentação está ativo apenas entre a terceira e a quarta semanas de desenvolvimento. “Isso antes mesmo que as mulheres saibam que estão grávidas”, diz Pourquié. “Portanto, não sabemos nada sobre isso. Este sistema in vitro fornece um proxy para estudarmos. ”
Em 2018, a equipe de Kageyama mostrou que poderia pegar células-tronco embrionárias de camundongo e transformá-las em tecido formador de somito, com expressão do gene Hes7 oscilante. Em 2019 e 2020, três grupos independentes, liderados por Pourquié, Ebisuya e o biólogo de células-tronco James Thomson no Morgridge Institute for Research em Madison, Wisconsin, mostraram que o mesmo truque poderia ser alcançado com células-tronco humanas 3-5.
Esses estudos revelaram muitas semelhanças entre o relógio de segmentação dos humanos e os de outros animais. Análogos dos mesmos genes e proteínas estão envolvidos em camundongos e humanos, por exemplo.
Mas havia uma diferença notável. O relógio de segmentação humana é lento. Cada oscilação leva de 5 a 6 horas, o dobro das 2 a 3 horas que leva em embriões de camundongo: um exemplo claro de heterocronia (consulte ?Desbloqueando o relógio de segmentação?). Mas por que o relógio de segmentação humana é tão lento e o que o está controlando?
Correndo devagar
Dois artigos publicados juntos na Science em setembro ofereceram uma resposta possível.
A equipe de Ebisuya se concentrou no gene Hes7, que ela chama de “o núcleo do relógio de segmentação”. Para verificar se as versões humana e de camundongo de Hes7 estavam controlando as diferentes velocidades das células, eles colocaram Hes7 humano em células de camundongo e Hes7 de camundongo em células humanas, então observaram para ver se as células humanas começaram a oscilar na velocidade de camundongo e vice-versa. Mas a velocidade das oscilações quase não mudou7. Outra coisa estava influenciando Hes7.
Para explorar isso, a equipe considerou como o Hes7 realmente funciona. Quando o gene está ativo, ele produz a proteína Hes7 e, quando uma quantidade suficiente da proteína se acumula, o gene é desativado. Então, uma vez que as proteínas Hes7 foram quebradas, o gene pode ser reativado. Desta forma, o Hes7 continua ligando e desligando.
A equipe de Ebisuya se perguntou se a proteína Hes7 poderia ser quebrada mais lentamente em células humanas do que em células de camundongo, e se isso seria responsável pelas oscilações mais lentas na atividade de Hes7 – e, portanto, o relógio de segmentação mais lento. Em outros experimentos, eles descobriram que a proteína Hes7 e seu modelo de RNA foram de fato degradados muito mais lentamente nas células humanas7.
Não está claro exatamente por que isso acontece. As proteínas Hes7 são degradadas por estruturas chamadas proteassomas, após serem marcadas para destruição. “Mas não sabemos qual parte desse processo de degradação é mais lento”, diz Ebisuya.
O que é intrigante é que essa lenta degradação das proteínas humanas não se limita ao Hes7, nem mesmo ao relógio de segmentação. Isso foi confirmado pelo segundo estudo, conduzido por James Briscoe, biólogo do desenvolvimento do Instituto Francis Crick, em Londres. Sua equipe estudou a diferenciação dos neurônios motores na medula espinhal de embriões de camundongos e humanos (ver ?Genes Speedy?). Isso ocorre em uma parte diferente do embrião da formação das vértebras e não envolve o relógio de segmentação. No entanto, o processo ainda é lento em humanos, levando cerca de 2 semanas, em comparação com 3-4 dias em camundongos.
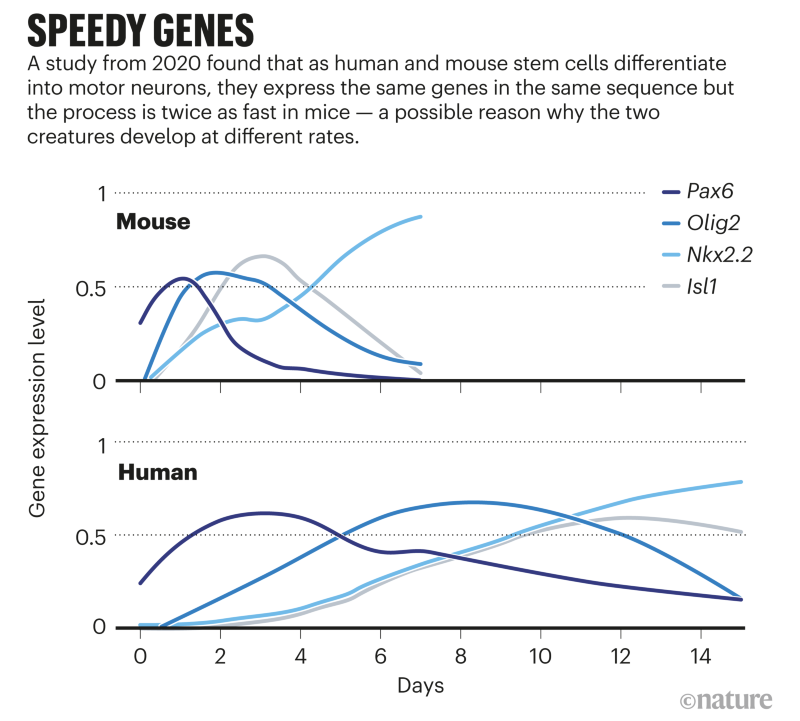
A equipe descobriu que as proteínas humanas demoravam cerca de duas vezes mais para se decompor do que as proteínas do camundongo – o que parecia estar determinando a velocidade de desenvolvimento dos neurônios motores. Isso é muito semelhante ao que Ebisuya descobriu, diz Briscoe. “Encontramos exatamente a mesma diferença de tempo na medula espinhal que ela estava encontrando na segmentação”.
As proteínas de camundongo e humana são quase idênticas, acrescenta Teresa Rayon, membro da equipe de Briscoe. Isso significa que é improvável que as proteínas do camundongo sejam inerentemente menos estáveis. “Suspeitamos que seja algo a ver com a forma como as proteínas são degradadas.”
No entanto, Blau e Vanderhaeghen são cautelosos sobre a ideia de que a taxa de degradação da proteína é a chave para a velocidade variável do relógio de segmentação. “Não sei se sabemos disso”, diz Blau. Os estudos descartaram algumas explicações para a diferença na velocidade, diz ela, mas ainda não provam que a taxa de degradação da proteína é a responsável.
Velocidade de reação
Enquanto isso, em experimentos não publicados, Ebisuya está explorando se todas as proteínas humanas são degradadas mais lentamente do que as proteínas de camundongo. “Achamos que há uma tendência geral de que as taxas de degradação se tornem mais lentas nas células humanas”, diz ela, mas pode não se aplicar a todas as proteínas. Sua equipe também tem evidências de que, além de serem degradadas a taxas mais lentas, as proteínas são produzidas mais lentamente nas células humanas do que em outras espécies. Vanderhaeghen diz que algum outro componente da célula, como ciclos metabólicos ou processos mitocondriais, também pode estar funcionando mais rápido ou mais devagar em diferentes espécies.
Os pesquisadores não têm certeza de por que as reações bioquímicas seriam sistematicamente mais lentas nas células humanas – como a diferença surge mecanicamente e por que surgiu na história evolutiva. Para Pourquié, o mecanismo ainda pode estar no genoma. “Deve haver algum tipo de truque genético que surgiu durante a evolução que leva a essa desaceleração de todos esses processos nas células humanas”, diz ele. Mas não está claro por que isso seria evolutivamente vantajoso.
A relativa lentidão das células humanas pode ser um produto de sua composição ou complexidade, diz J. Kim Dale, biólogo do desenvolvimento da Universidade de Dundee, no Reino Unido. Por exemplo, a máquina de degradação pode se encontrar lutando para acompanhar a demanda, desacelerando as reações. “Com as informações que temos, isso sugere que é o ambiente celular”, diz ela.
Os estudos do relógio de segmentação in vitro poderiam muito bem resolver essa questão, mas também sugerir um mistério mais amplo: as células humanas funcionam mais devagar do que as de outras espécies, não apenas durante períodos específicos de desenvolvimento, mas ao longo de nossas vidas? Se for assim, isso poderia ajudar a explicar por que nossa expectativa de vida é estendida em comparação com a de outras espécies.
É muito cedo para ter certeza, mas um estudo de janeiro sugere que essas variações nas velocidades de reação bioquímica são profundas na biologia. Uma equipe liderada por Sina Ghaemmaghami, que estuda proteômica na Universidade de Rochester, em Nova York, comparou a velocidade com que proteínas foram criadas e destruídas nas células da pele de 12 mamíferos, desde hamsters dourados que mal vivem 4 anos, até humanos baleias que podem viver 200 anos.
“Achei que não veríamos muita diferença”, diz Ghaemmaghami. Livros didáticos de proteômica costumam argumentar que a meia-vida de uma proteína é inerente à sua estrutura, diz ele, então essas proteínas altamente conservadas – que variam pouco entre as espécies – deveriam durar quase o mesmo em todos os animais. Mas, na verdade, a equipe encontrou uma forte correlação inversa com a expectativa de vida: espécies de vida mais longa tiveram uma rotação mais lenta de proteínas.
Os animais de vida mais longa estão simplesmente correndo mais devagar no nível bioquímico? “Essa é a pergunta de um milhão de dólares”, diz Ghaemmaghami. “Será que a lenta rotação está de alguma forma causando longa vida, ou esses organismos têm longa vida por uma razão completamente independente e então podem ajustar sua taxa de rotação? É muito difícil saber. ”
Por enquanto, a hipótese de trabalho de Ghaemmaghami é que a lentidão é uma consequência da longa vida útil. Ele ressalta que produzir e quebrar proteínas rapidamente é uma coisa boa, porque garante que as células usem proteínas de alta qualidade – mas toda essa atividade libera resíduos nocivos que podem danificar a célula. “Se você é um organismo de vida longa, você não pode simplesmente transformar suas proteínas rapidamente, porque você danifica todo o resto”, diz ele. Em vez disso, sua equipe acredita que animais de vida longa reduzem a rotatividade geral e identificam apenas proteínas danificadas para degradação.
Ebisuya acha que a velocidade das reações químicas pode ser a chave para essas diferenças, mas ela quer descobrir o mecanismo antes de estar pronta para generalizar. “Ainda não tenho certeza se mecanismos semelhantes podem explicar outros processos biológicos”, diz ela.
Pode levar algum tempo, mas os relógios que Ebisuya e outros construíram prometem revelar muito mais sobre como os animais funcionam.
Publicado em 29/04/2021 12h20
Artigo original:
Estudo original:


