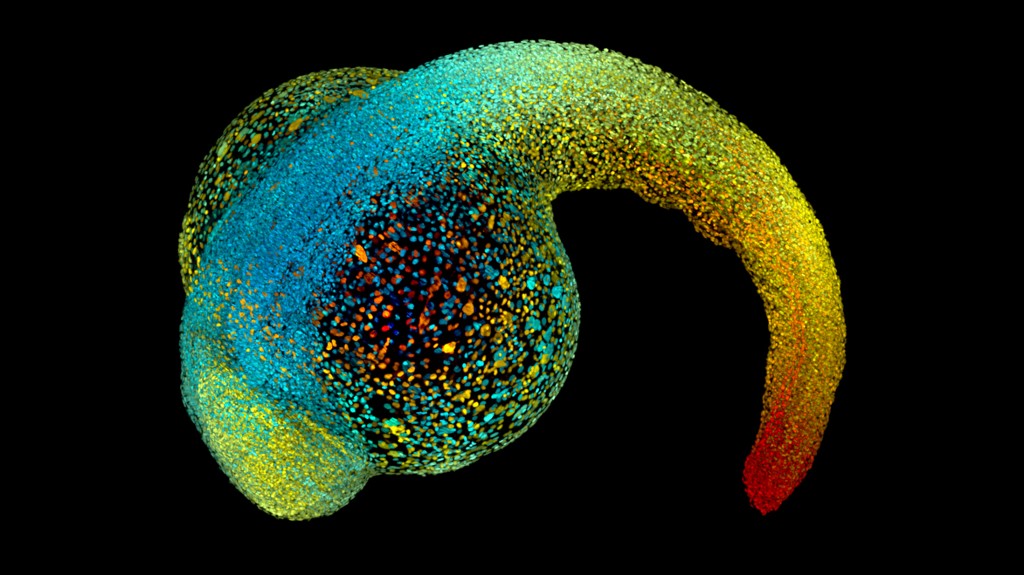
No início, um embrião não tem frente ou costas, cabeça ou cauda. É uma esfera simples de células. Mas logo, a massa lisa começa a mudar. O fluido se acumula no meio da esfera. As células fluem como mel para assumir suas posições no futuro corpo. Folhas de células se dobram em estilo origami, construindo um coração, um intestino, um cérebro.
Nada disso poderia acontecer sem forças que apertam, dobram e puxam o animal em crescimento para a forma. Mesmo quando atinge a idade adulta, suas células continuarão a responder a empurrões e puxões – das outras e do ambiente.
No entanto, a maneira como os corpos e tecidos tomam forma continua sendo “uma das questões mais importantes e ainda mal compreendidas de nosso tempo”, diz a bióloga do desenvolvimento Amy Shyer, que estuda a morfogênese na Universidade Rockefeller, em Nova York. Durante décadas, os biólogos se concentraram nas maneiras como os genes e outras biomoléculas moldam os corpos, principalmente porque as ferramentas para analisar esses sinais estão prontamente disponíveis e estão sempre melhorando. As forças mecânicas receberam muito menos atenção.
Mas considerar apenas genes e biomoléculas é “como se você estivesse tentando escrever um livro com apenas metade das letras do alfabeto”, diz Xavier Trepat, mecanobiólogo do Instituto de Bioengenharia da Catalunha em Barcelona, Espanha.
Nos últimos 20 anos, mais cientistas começaram a prestar atenção à importância da mecânica em uma variedade de estágios de desenvolvimento, órgãos e organismos. Os pesquisadores começaram a definir os mecanismos pelos quais as células sentem, respondem e geram forças. Eles fizeram isso inventando ferramentas e truques personalizados, incorporando lasers e micropipetas, partículas magnéticas e microscópios personalizados. A maioria dos pesquisadores está sondando sinais mecânicos usando células ou tecidos cultivados em um prato. Mas alguns grupos estão estudando animais inteiros e, às vezes, encontram princípios diferentes em ação daqueles aparentes em tecidos isolados. Esses estudos in vivo apresentam muitos desafios – como medir pequenas quantidades de força em tecidos complexos – mas são essenciais para entender o papel da força na escultura da vida, diz Roberto Mayor, biólogo do desenvolvimento da University College London.
Conforme um punhado de cientistas determinados começa a superar esses desafios, eles observam forças cruciais que moldam a biologia – desde os primeiros estágios da existência de um embrião até doenças que atacam mais tarde na vida. No futuro, essas informações podem ajudar os cientistas a projetar melhores intervenções para problemas como infertilidade ou câncer.
“As forças operarão em cada instância em que a forma estiver em jogo”, diz Thomas Lecuit, biólogo do desenvolvimento do Instituto de Biologia do Desenvolvimento de Marselha, na França.
Forte desde o início
Antes que um embrião possa tomar forma, ele precisa quebrar a simetria da bola lisa de células. Tendo começado a compreender os controles genéticos e químicos sobre esse processo, os cientistas estão agora adquirindo mais conhecimento sobre a mecânica. “Aos poucos, uma imagem completa do papel das forças mecânicas no desenvolvimento está aparecendo”, diz o biólogo Jean-Léon Maître, do Instituto Curie, em Paris. Por exemplo, propriedades físicas como pressão de fluido e densidade celular são fundamentais para o embrião de mamífero criar sua frente, costas, cabeça e cauda.
O grupo de Maître investigou como a bola inicial de células que compreende o embrião de camundongo precoce desenvolve uma grande cavidade cheia de fluido chamada lúmen. À medida que essa cavidade se enche, as células que formarão o feto são pressionadas juntas de um lado. Este primeiro evento de quebra de simetria garante que o embrião se implante na parede uterina corretamente, e também governa qual lado do embrião ficará as costas e qual será a barriga. O que não estava claro era como o embrião cria e posiciona o lúmen (ver “Pressão para se desenvolver”).

Quando eles imaginaram o processo em detalhes, a equipe de Maître encontrou algo inesperado. “Vimos essas pequenas bolhas, essas pequenas bolsas de água se formando entre as células”, diz Maître. “Eles são transitórios – você apenas os perde se não conseguir imagens com rapidez suficiente.” O fluido nessas bolhas vem do líquido que envolve o embrião1, forçado para dentro pela maior concentração de moléculas de água externas. Em seguida, a equipe viu a água das bolhas individuais fluir, provavelmente através de lacunas entre as células, pensa Maître, em um único grande lúmen.
Os pesquisadores confirmaram como isso estava acontecendo observando as proteínas que abrangem as lacunas entre as células, que fazem contato umas com as outras para unir as células2. Conforme as bolhas apareciam, essas proteínas de adesão pareciam se quebrar à medida que as células eram separadas. As células com menos proteínas de adesão foram mais fáceis de separar à força.
Esta é a primeira observação de que o fluido pressurizado pode esculpir o embrião quebrando as ligações entre as células, diz Maître. Por que o embrião forçaria as células a se separarem para se construir? “Definitivamente, parece ineficiente e arriscado”, diz ele. Seu melhor palpite é que essa estratégia evoluiu não porque seja a melhor solução para o problema, mas porque é “boa o suficiente”. Ele espera que uma maior compreensão da mecânica do embrião, que a equipe agora está estudando em células humanas, possa ajudar as clínicas de fertilização in vitro a identificar quais embriões implantar para uma gravidez bem-sucedida.
Mais tarde no desenvolvimento, os embriões quebram a simetria em outra direção, diferenciando a cabeça da cauda. Otger Campàs, físico biológico da Universidade da Califórnia, em Santa Bárbara, acompanhou o processo de crescimento da cauda em embriões de peixe-zebra (Danio rerio) 3. Seu grupo mediu as forças envolvidas ao injetar gotículas de óleo carregadas com nanopartículas magnéticas nos espaços entre as células. Em seguida, os pesquisadores aplicaram um campo magnético para deformar as gotículas, para que pudessem medir como os tecidos reagiram ao impulso.
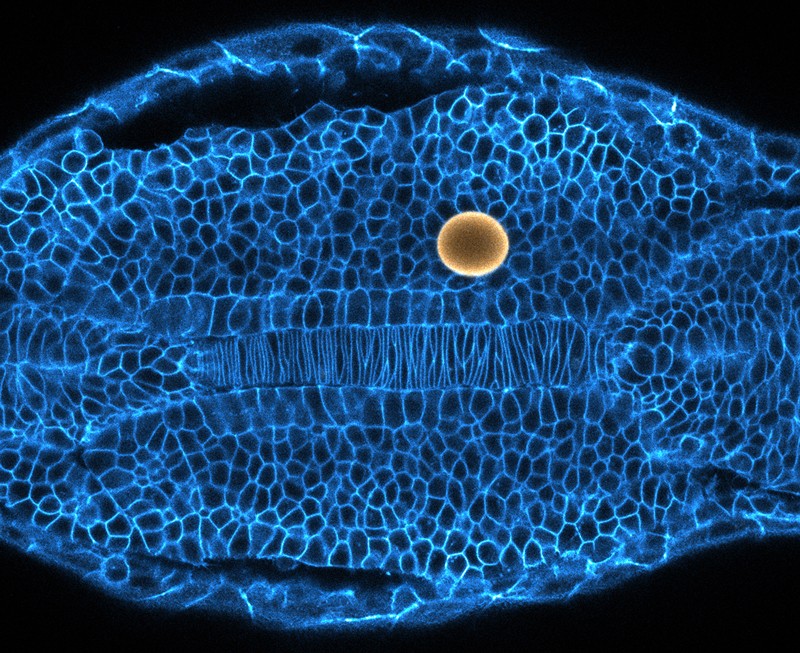
Eles descobriram que a ponta da cauda em crescimento estava em um estado que os físicos chamam de “fluido” – as células fluíam livremente e, quando pressionadas, o tecido se deformava facilmente. Quanto mais longe os cientistas se afastavam da cauda, mais rígido o tecido se tornava. “Sabíamos que estava se solidificando, mas não conhecíamos o mecanismo”, lembra Campàs.
Não havia nada entre as células que aumentaria a rigidez – nenhuma molécula formando uma matriz estrutural – mas quando os pesquisadores mediram os espaços entre as células, eles os encontraram totalmente abertos na ponta da cauda, mas menores perto da cabeça4. Conforme as células se aglomeraram, o tecido se solidificou. Campàs compara a transição aos grãos de café sendo embalados: os grãos fluem livremente para um saco, mas tornam-se tão embalados que o saco cheio parece um tijolo. Ele planeja investigar se esse mecanismo está por trás da formação de outras estruturas embrionárias, como botões de membros.
Fazendo corações e mentes
Uma vez que o embrião em desenvolvimento tenha se mapeado, órgãos individuais começam a se formar. “Fundamentalmente, não entendemos como qualquer órgão interno se forma”, diz Timothy Saunders, biólogo do desenvolvimento da Universidade Nacional de Cingapura. (A única exceção, observa ele, é o intestino.)
Isso está começando a mudar. O grupo de Saunders, por exemplo, examinou a formação do coração em embriões da mosca da fruta Drosophila. Há um evento crucial quando dois pedaços de tecido se juntam para formar um tubo que acabará por se tornar o coração. Cada peça contém dois tipos de células do músculo cardíaco. As peças devem fechar corretamente, combinando uma com a outra, para que um coração saudável surja. “Frequentemente víamos desalinhamentos que eram corrigidos”, diz Saunders. “O que está causando a correção
Acabou sendo uma força de dentro das próprias células do coração. Uma proteína chamada miosina II, uma prima próxima da proteína que faz as células musculares se contraírem, era conhecida por fluir do meio de cada célula até sua borda, para frente e para trás, durante o processo de compactação. O então estudante graduado Shaobo Zhang – que agora está se preparando para uma posição de pós-doutorado na Universidade da Califórnia, em San Francisco – se perguntou se a miosina poderia criar uma força que puxa as células emparelhadas, quebrando qualquer conexão entre tipos incompatíveis.
Para testar sua teoria, Zhang separou as células emparelhadas com um laser. As células se afastaram umas das outras, como um elástico tenso cortado com uma tesoura. “Podíamos ver um belo recuo”, diz Saunders. Mas quando a equipe separou células sem miosina II, “simplesmente vai, mmph, nada acontece”. A miosina, como dedos separando um elástico, estava criando a força para puxar as conexões por dentro5. As células incompatíveis, com seus links quebrados, teriam outra chance de encontrar os parceiros certos.
A proliferação celular simples também pode sinalizar as células para se organizarem adequadamente, como pesquisadores da Universidade de Cambridge, no Reino Unido, descobriram em embriões da rã Xenopus com garras. A equipe, liderada pelo biólogo físico Kristian Franze, já sabia que, à medida que o olho e o cérebro se conectam, os neurônios do olho enviam seus axônios – longas projeções que os neurônios usam para entrar em contato uns com os outros – ao longo de um caminho definido pela rigidez do tecido cerebral . Os axônios do olho seguem tecidos mais suaves em direção a um centro central no cérebro em desenvolvimento6.
Para determinar quando e como esse caminho se forma, a equipe construiu um microscópio personalizado com o qual eles poderiam assistir simultaneamente o processo in vivo enquanto mediam a rigidez do tecido com uma pequena sonda7. Eles viram o gradiente de rigidez aparecer cerca de 15 minutos antes de os axônios chegarem para segui-lo, diz Franze, que também dirige o Instituto de Física Médica e Engenharia de Microtissue da Universidade de Erlangen-Nuremberg, na Alemanha.
Como o gradiente é formado? Como nas caudas do peixe-zebra em desenvolvimento, o tecido mais rígido no cérebro das rãs parecia conter uma densidade maior de células. Quando a equipe bloqueou a divisão celular nos embriões em desenvolvimento, o gradiente de rigidez nunca apareceu – e os axônios não conseguiam encontrar seu caminho. Preencher um espaço com células parece ser uma maneira rápida e eficaz de orientar a instalação do sistema nervoso.
Pressão contínua
Animais totalmente desenvolvidos também precisam enfrentar forças, à medida que continuam a crescer ou a enfrentar doenças. Por exemplo, quando um corpo se expande, a pele cresce para cobri-lo. Os cirurgiões tiram vantagem disso na reconstrução da mama, onde é necessária mais pele para cobrir o implante planejado. Primeiro, eles inserem um “balão” e o insuflam gradualmente com solução salina ao longo de um período de meses, esticando a pele existente, até que uma quantidade suficiente de pele tenha crescido para ser usada em uma segunda cirurgia.
Mas como as células da pele respondem a essa pressão e se multiplicam? A bióloga de células-tronco Mariaceleste Aragona abordou a questão como pós-doutoranda na Université Libre de Bruxelles, na Bélgica, trabalhando com Cédric Blanpain. Ela implantou uma pastilha de um hidrogel autoexpansível sob a pele em camundongos8. À medida que o hidrogel absorveu o fluido, até um volume final de 4 mililitros, a pele se esticou ao redor dele. Um dia depois de implantar o hidrogel, Aragona viu as células-tronco sob a camada externa da pele começarem a se multiplicar, fornecendo a matéria-prima que poderia se diferenciar em uma nova pele.
Mas nem todas as células-tronco proliferaram em resposta a esse alongamento. Apenas uma subpopulação, anteriormente indefinida, começou a produzir novas células-tronco. “Ainda não sabemos por quê”, diz Aragona, agora na Universidade de Copenhagen. A compreensão desse sistema pode levar a métodos para promover o crescimento da pele para reconstrução cirúrgica ou cicatrização de feridas, acrescenta Blanpain.
As propriedades mecânicas dos tecidos também desempenham um papel no crescimento celular anormal, como no câncer. “Os tumores sólidos são mais rígidos do que os tecidos normais”, diz Trepat. Em parte, isso se deve a um excesso de uma malha fibrosa chamada matriz extracelular ao redor das células e também porque as próprias células cancerosas estão proliferando, diz ele.
“A rigidez torna as células cancerosas mais malignas”, acrescenta Trepat, e se os cientistas pudessem entender por que, diz ele, eles poderiam ser capazes de projetar tratamentos que mudassem essas propriedades físicas e tornassem o câncer menos perigoso.
Em um estudo relacionado, pesquisadores da Universidade Rockefeller identificaram forças mecânicas que explicam por que alguns cânceres de pele são benignos e outros malignos. As células-tronco da pele dão origem a dois tipos diferentes de câncer: carcinoma basocelular, que não se espalha além da pele, e carcinoma espinocelular invasivo. Cada um pressiona a membrana basal subjacente, uma camada de proteínas estruturais que separa as camadas externas da pele do tecido mais profundo. O tumor de células basais benigno raramente rompe a membrana basal, mas sua contraparte mais agressiva muitas vezes escapa para cruzar a vasculatura e se alojar em outras partes do corpo (consulte “A mecânica do câncer de pele”).
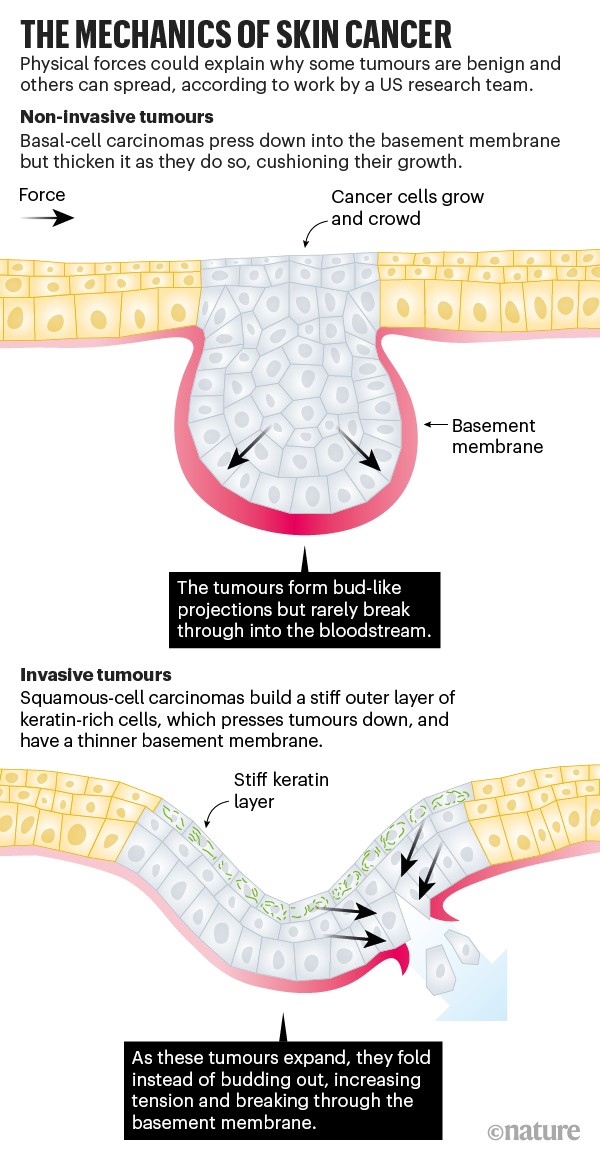
Trabalhando com pele de camundongos, os biólogos de células-tronco Elaine Fuchs e Vincent Fiore descobriram que o câncer benigno construía uma membrana basal mais espessa e macia, que continha as células tumorais como uma luva à medida que pressionavam para baixo. Mas o tumor agressivo promoveu uma membrana basal mais fina.
Uma força vinda de cima também ajudou os tumores invasivos a escapar. Os carcinomas de células escamosas formam uma camada rígida de células diferenciadas da pele, chamada de pérola de queratina. Ao pressionar o topo do carcinoma, a pérola ajuda o tumor a romper a frágil membrana basal como um punho através do vidro9.
Antes desse trabalho, diz Fuchs, os pesquisadores presumiam que células diferenciadas da pele, aquelas com identidades fixas, não podiam produzir forças mecânicas. “Essa é, eu acho, a principal surpresa”, diz ela.
Em seguida, Fuchs e Fiore planejam investigar como as células percebem essas forças mecânicas e como elas convertem a força em um programa de expressão gênica que pode produzir mais membrana basal ou promover a diferenciação.
Essa questão – como forças e genes estão ligados – é fundamental, diz Alan Rodrigues, biólogo do desenvolvimento da Universidade Rockefeller. E não é apenas um problema de câncer de pele. “A questão profunda na mecânica é realmente pensar sobre como ela se relaciona com as moléculas”, diz ele.
Outros também estão investigando este link. “Não se trata apenas, você sabe, de” os genes fazem tudo “ou” a mecânica faz tudo , diz Lecuit. “Vai ser um diálogo interessante entre os dois.”
Publicado em 16/01/2021 01h09
Artigo original:


