
A imagem PET da interação reativa astrócitos-neurônios revela novos insights sobre a patologia da doença de Alzheimer, oferecendo um potencial avanço no diagnóstico e tratamento.
Recentemente, uma equipe de cientistas sul-coreanos liderada pelo diretor C. Justin LEE, do Centro de Cognição e Socialidade do Instituto de Ciências Básicas, fez uma nova descoberta que pode revolucionar tanto o diagnóstico quanto o tratamento da doença de Alzheimer. O grupo demonstrou um mecanismo em que os astrócitos no cérebro captam níveis elevados de acetato, o que os transforma em astrócitos reativos perigosos. Eles então desenvolveram uma nova técnica de imagem que aproveita esse mecanismo para observar diretamente as interações astrócitos-neurônios.
A doença de Alzheimer (DA), uma das principais causas de demência, é conhecida por estar associada à neuroinflamação no cérebro. Embora a neurociência tradicional acredite há muito tempo que as placas beta-amilóides sejam a causa, os tratamentos direcionados a essas placas tiveram pouco sucesso no tratamento ou na redução da progressão da doença de Alzheimer.
Por outro lado, o diretor C. Justin LEE tem defendido uma nova teoria de que os astrócitos reativos são os verdadeiros culpados por trás da doença de Alzheimer. A astrogliose reativa, uma característica da neuroinflamação na DA, geralmente precede a degeneração ou morte neuronal.
A equipe de pesquisa de Lee relatou anteriormente que os astrócitos reativos e a enzima monoamina oxidase B (MAO-B) dentro dessas células podem ser utilizados como alvos terapêuticos para a DA. Recentemente, eles também confirmaram a existência de um ciclo da uréia nos astrócitos e demonstraram que o ciclo da uréia ativado promove a demência. No entanto, apesar da importância clínica dos astrócitos reativos, ainda não foram desenvolvidas sondas de neuroimagem cerebral que possam observar e diagnosticar essas células em nível clínico.
Nesta última pesquisa, a equipe de Lee usou imagens de tomografia por emissão de pósitrons (PET) com acetato radioativo e sondas de glicose (11C-acetato e 18F-FDG) para visualizar as mudanças no metabolismo neuronal em pacientes com DA.
O Dr. NAM Min-Ho, um dos primeiros autores deste artigo, declarou: “Este estudo demonstra valor acadêmico e clínico significativo ao visualizar diretamente astrócitos reativos, que recentemente foram destacados como a principal causa da DA”.
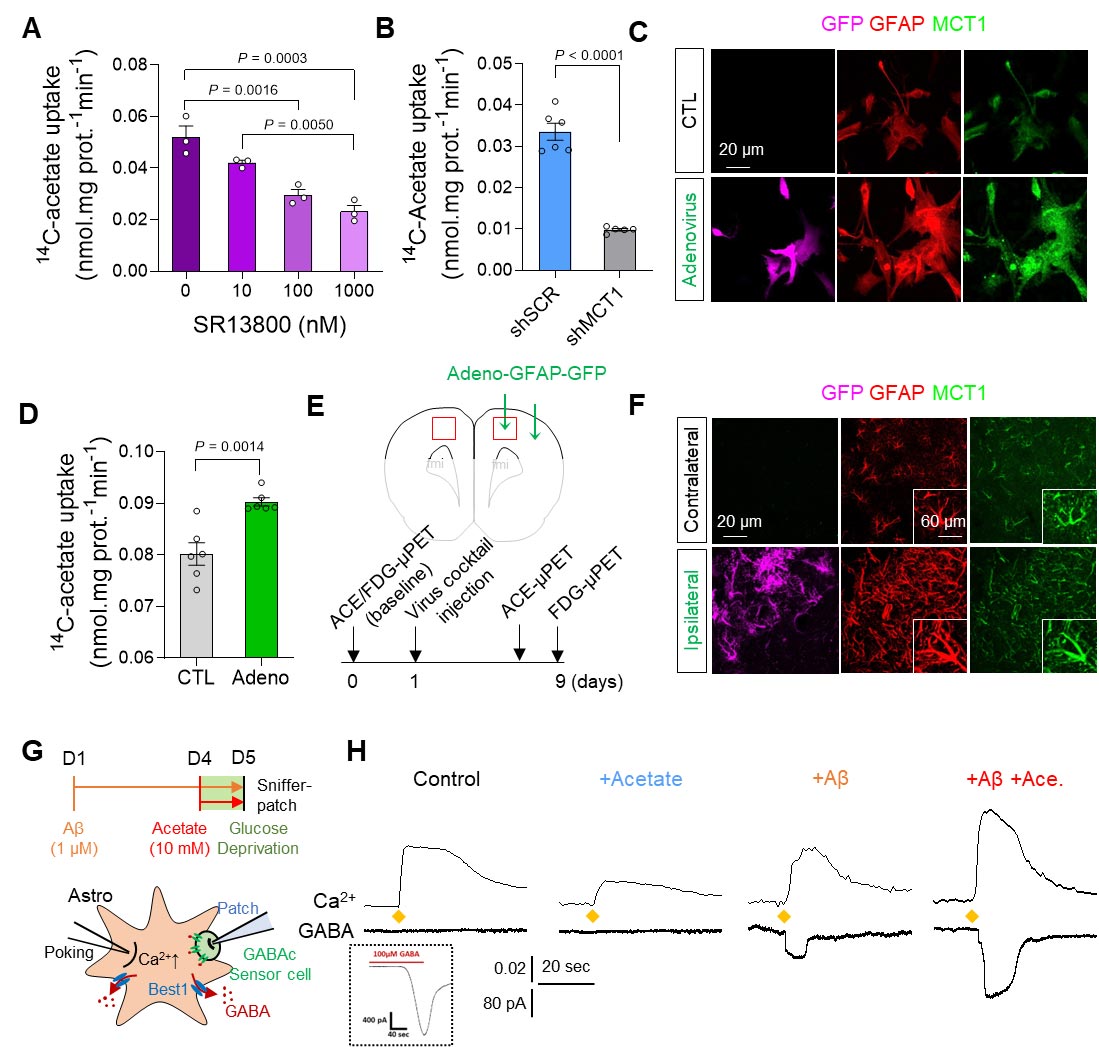
Além disso, demonstraram que o acetato, principal componente do vinagre, é responsável por promover a astrogliose reativa, que induz a produção de putrescina e GABA e leva à demência. Primeiro, os pesquisadores demonstraram que os astrócitos reativos absorvem excessivamente o acetato através do transportador de monocarboxilato-1 elevado (MCT1) em modelos de roedores de astrogliose reativa e DA (Figura 1A a 1F). Descobriu-se que a captação elevada de acetato está associada à astrogliose reativa e aumenta a síntese aberrante de GABA astrocítico quando o beta-amilóide, uma proteína toxina bem conhecida na DA, está presente (Figura 1G e 1H).
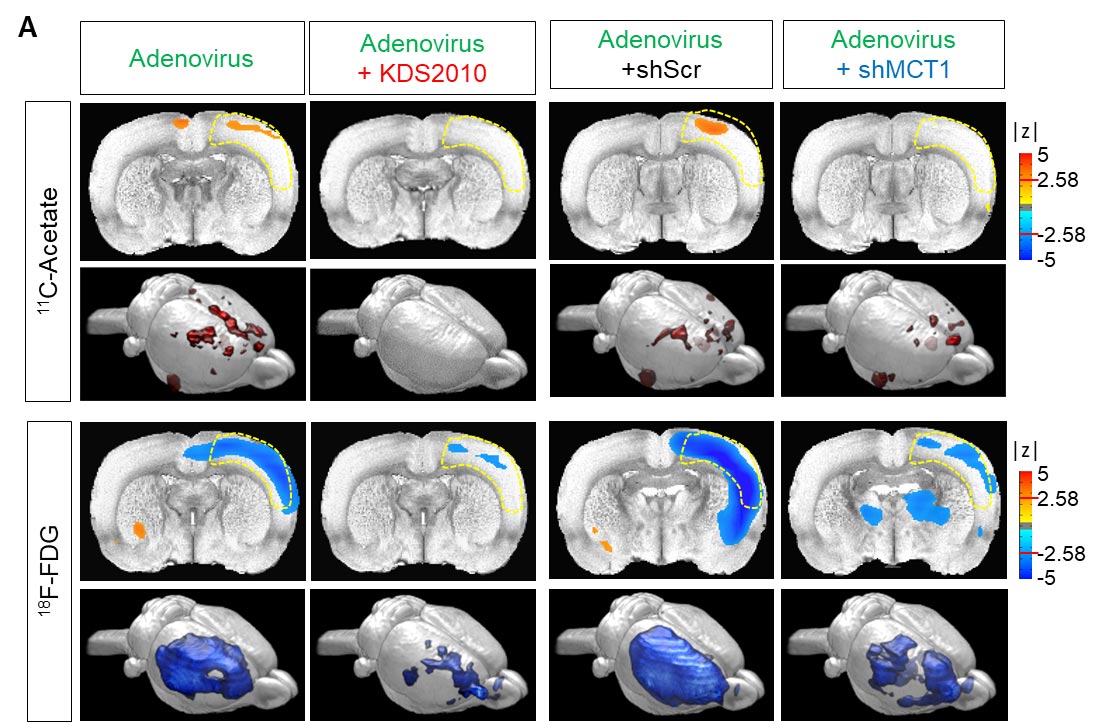
Os pesquisadores mostraram que a imagem PET com acetato de 11C e 18F-FDG pode ser usada para visualizar o hipermetabolismo de acetato induzido por astrócitos reativos e o hipometabolismo de glicose neuronal associado nos cérebros com neuroinflamação e DA (Figura 2A). Além disso, quando os pesquisadores inibiram a astrogliose reativa e a expressão astrocítica do MCT1 no modelo de camundongo com DA, eles conseguiram reverter essas alterações metabólicas.
O Dr. YUN Mijin comentou: “Os astrócitos reativos mostraram anormalidades metabólicas que absorvem excessivamente o acetato em comparação com o estado normal. Descobrimos que o acetato desempenha um papel importante na promoção de respostas inflamatórias astrocíticas”.
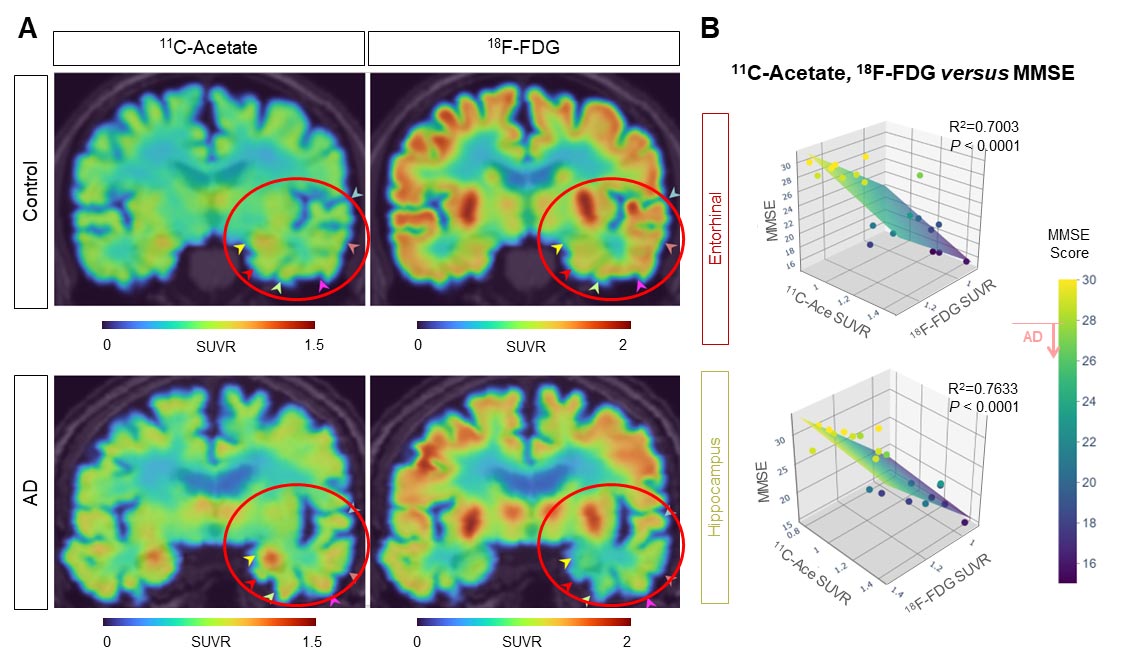
Ao usar essa nova estratégia de imagem, o grupo descobriu que alterações no metabolismo do acetato e da glicose foram consistentemente observadas no modelo de camundongos com DA e em pacientes humanos com DA (Figura 3A). Eles foram capazes de confirmar que existe uma forte correlação entre a função cognitiva do paciente e os sinais PET de 11C-acetato e 18F-FDG (Figura 3B). Esses resultados sugerem que o acetato, anteriormente considerado uma fonte de energia específica dos astrócitos, pode facilitar a astrogliose reativa e contribuir para a supressão do metabolismo neuronal.
O Dr. RYU Hoon comentou: “Ao demonstrar que o acetato não apenas atua como fonte de energia para os astrócitos, mas também facilita a astrogliose reativa, sugerimos um novo mecanismo que induz a astrogliose reativa em doenças cerebrais”.
Até agora, suspeitava-se que o beta-amilóide (Aβ) era a principal causa da DA e, portanto, era o foco principal da maioria das pesquisas sobre demência. Infelizmente, a imagem de PET visando o Aβ teve limitações no diagnóstico de pacientes, e as drogas destinadas a removê-lo como um alvo para o tratamento da DA falharam até agora. No entanto, este estudo nos oferece uma nova possibilidade de usar 11C-acetato e 18F-FDG PET para o diagnóstico precoce da DA. Além disso, o mecanismo recém-descoberto de astrogliose reativa através do acetato e do transportador MCT1 sugere um novo alvo para o tratamento da DA.
O Dr. C. Justin LEE declarou: “Confirmamos uma recuperação significativa ao inibir o MCT1, transporte de acetato específico de astrócitos, em um modelo animal de DA”, e acrescentou: “Esperamos que o MCT1 possa ser um novo alvo terapêutico para a DA”.
Publicado em 22/04/2023 21h21
Artigo original:
Estudo original:


