
Um grande avanço da equipe de engenharia da Columbia demonstra o primeiro chip de vários órgãos feito de tecidos humanos projetados ligados por fluxo vascular para melhorar a modelagem de doenças sistêmicas como o câncer.
Os tecidos modificados tornaram-se um componente essencial para modelar doenças e testar a eficácia e segurança de medicamentos em um contexto humano. Um obstáculo importante para os pesquisadores tem sido descobrir como modelar as funções do corpo e doenças sistêmicas com vários tecidos projetados que podem se comunicar fisiologicamente – assim como fazem no corpo. No entanto, é essencial fornecer a cada tecido manipulado seu próprio ambiente para que os fenótipos específicos do tecido possam ser mantidos por semanas a meses, conforme necessário para estudos biológicos e biomédicos. Tornar o desafio ainda mais complexo é a necessidade de conectar os módulos de tecido para facilitar sua comunicação fisiológica, que é necessária para modelar condições que envolvem mais de um sistema de órgãos, sem sacrificar os ambientes individuais de tecidos projetados.
Novo chip multi-órgão plug-and-play, personalizado para o paciente
Até agora, ninguém foi capaz de satisfazer as duas condições. Hoje, uma equipe de pesquisadores da Columbia Engineering e do Columbia University Irving Medical Center relata que eles desenvolveram um modelo de fisiologia humana na forma de um chip de múltiplos órgãos que consiste em coração, osso, fígado e pele humanos projetados que estão ligados por fluxo vascular com células imunes circulantes, para permitir a recapitulação de funções orgânicas interdependentes. Os pesquisadores criaram essencialmente um chip de vários órgãos plug-and-play, que é do tamanho de uma lâmina de microscópio, que pode ser personalizado para o paciente. Como a progressão da doença e as respostas ao tratamento variam muito de uma pessoa para outra, esse chip eventualmente permitirá a otimização personalizada da terapia para cada paciente. O estudo é a matéria de capa da edição de abril de 2022 da revista Nature Biomedical Engineering.
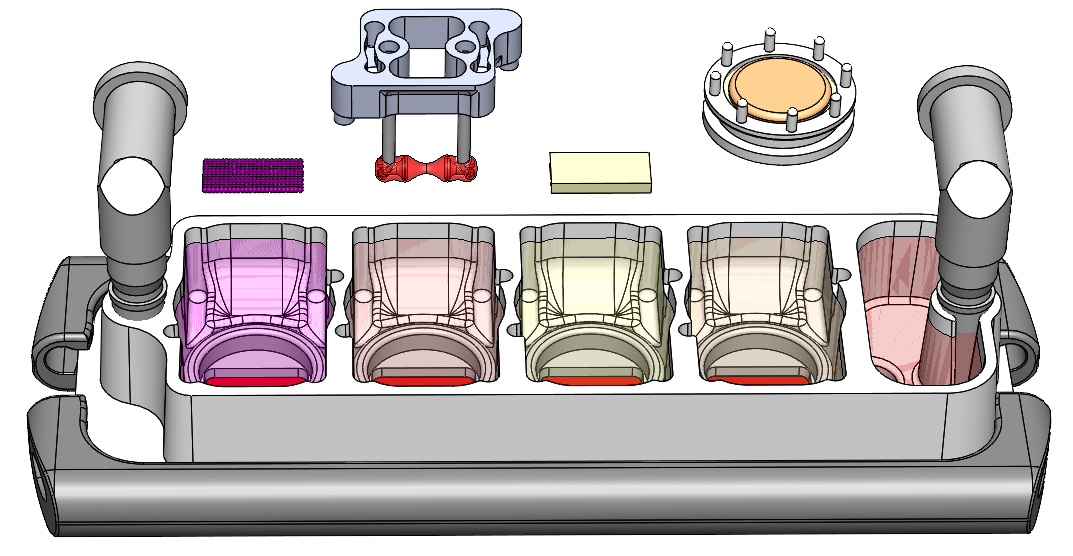
“Esta é uma grande conquista para nós – passamos dez anos executando centenas de experimentos, explorando inúmeras grandes ideias e construindo muitos protótipos, e agora finalmente desenvolvemos esta plataforma que captura com sucesso a biologia das interações de órgãos no corpo”, disse a líder do projeto Gordana Vunjak-Novakovic, professora universitária e professora da Fundação Mikati de Engenharia Biomédica, Ciências Médicas e Medicina Dentária.
Inspirado no corpo humano
Inspirando-se em como o corpo humano funciona, a equipe construiu um sistema de chip de tecido humano no qual eles ligaram módulos de tecido cardíaco, fígado, osso e pele amadurecidos ao recircular o fluxo vascular, permitindo que órgãos interdependentes se comuniquem exatamente como fazem em o corpo humano. Os pesquisadores escolheram esses tecidos porque eles têm origens embrionárias, propriedades estruturais e funcionais distintamente diferentes e são afetados adversamente por medicamentos para o tratamento do câncer, apresentando um teste rigoroso da abordagem proposta.
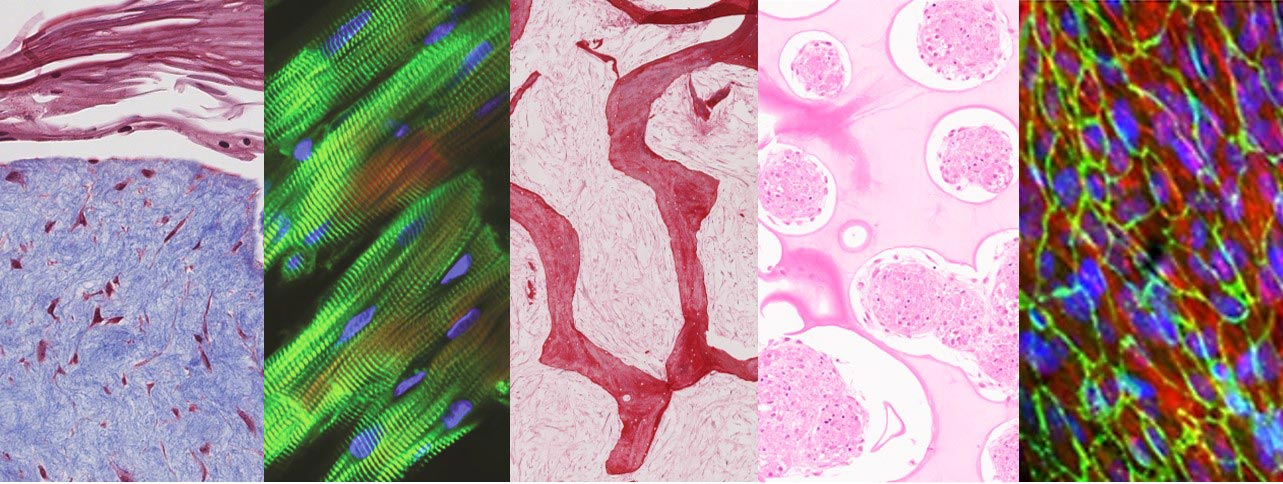
“Fornecer comunicação entre tecidos preservando seus fenótipos individuais tem sido um grande desafio”, disse Kacey Ronaldson-Bouchard, principal autor do estudo e pesquisador associado do Laboratório de Células-Tronco e Engenharia de Tecidos de Vunjak-Novakovic. “Como nos concentramos no uso de modelos de tecidos derivados do paciente, devemos amadurecer individualmente cada tecido para que funcione de uma maneira que imite as respostas que você veria no paciente, e não queremos sacrificar essa funcionalidade avançada ao conectar vários tecidos. No corpo, cada órgão mantém seu próprio ambiente, enquanto interage com outros órgãos pelo fluxo vascular que transporta células circulantes e fatores bioativos. Por isso, optamos por conectar os tecidos pela circulação vascular, preservando cada nicho de tecido individual necessário para manter sua fidelidade biológica, imitando a maneira como nossos órgãos estão conectados dentro do corpo.”
Módulos de tissue otimizados podem ser mantidos por mais de um mês
O grupo criou módulos de tecido, cada um dentro de seu ambiente otimizado e os separou do fluxo vascular comum por uma barreira endotelial seletivamente permeável. Os ambientes de tecidos individuais foram capazes de se comunicar através das barreiras endoteliais e através da circulação vascular. Os pesquisadores também introduziram na circulação vascular os monócitos que dão origem aos macrófagos, por causa de seus papéis importantes no direcionamento das respostas dos tecidos a lesões, doenças e resultados terapêuticos.
Todos os tecidos foram derivados da mesma linha de células-tronco pluripotentes induzidas por humanos (iPSC), obtidas a partir de uma pequena amostra de sangue, a fim de demonstrar a capacidade de estudos individualizados e específicos do paciente. E, para provar que o modelo pode ser usado para estudos de longo prazo, a equipe manteve os tecidos, que já haviam crescido e amadurecidos por quatro a seis semanas, por mais quatro semanas, depois de ligados por perfusão vascular.
Usando o modelo para estudar drogas anticancerígenas
Os pesquisadores também queriam demonstrar como o modelo poderia ser usado para estudos de uma importante condição sistêmica em um contexto humano e optaram por examinar os efeitos adversos dos medicamentos anticâncer. Eles investigaram os efeitos da doxorrubicina – uma droga anticâncer amplamente utilizada – no coração, fígado, ossos, pele e vasculatura. Eles mostraram que os efeitos medidos recapitularam os relatados em estudos clínicos de terapia contra o câncer usando o mesmo medicamento.
A equipe desenvolveu em paralelo um novo modelo computacional do chip de múltiplos órgãos para simulações matemáticas de absorção, distribuição, metabolismo e secreção de drogas. Este modelo previu corretamente o metabolismo da doxorrubicina em doxorrubicinol e sua difusão no chip. A combinação do chip de múltiplos órgãos com a metodologia computacional em futuros estudos de farmacocinética e farmacodinâmica de outros medicamentos fornece uma base aprimorada para extrapolação pré-clínica para clínica, com melhorias no pipeline de desenvolvimento de medicamentos.
“Ao fazer isso, também conseguimos identificar alguns marcadores moleculares iniciais de cardiotoxicidade, o principal efeito colateral que limita o amplo uso do medicamento. Mais notavelmente, o chip de múltiplos órgãos previu precisamente a cardiotoxicidade e a cardiomiopatia que muitas vezes exigem que os médicos diminuam as doses terapêuticas de doxorrubicina ou até mesmo interrompam a terapia”, disse Vunjak-Novakovic.
Colaborações em toda a universidade
O desenvolvimento do chip de múltiplos órgãos começou a partir de uma plataforma com coração, fígado e vasculatura, apelidada de plataforma HeLiVa. Como sempre acontece com a pesquisa biomédica de Vunjak-Novakovic, as colaborações foram fundamentais para a conclusão do trabalho. Estes incluem o talento coletivo de seu laboratório, Andrea Califano e sua equipe de biologia de sistemas (Universidade de Columbia), Christopher S. Chen (Universidade de Boston) e Karen K. Hirschi (Universidade de Virgínia) com sua experiência em biologia e engenharia vascular, Angela M Christiano e sua equipe de pesquisa de pele (Columbia University), Rajesh K. Soni do Proteomics Core da Columbia University, e o suporte de modelagem computacional da equipe da CFD Research Corporation.
Uma infinidade de aplicações, todas em contextos individualizados específicos do paciente
A equipe de pesquisa está atualmente usando variações deste chip para estudar, todos em contextos específicos de pacientes individualizados: metástase de câncer de mama; metástase de câncer de próstata; leucemia; efeitos da radiação nos tecidos humanos; os efeitos do SARS-CoV-2 no coração, pulmão e vasculatura; os efeitos da isquemia no coração e no cérebro; e a segurança e eficácia dos medicamentos. O grupo também está desenvolvendo um chip padronizado de fácil utilização para laboratórios acadêmicos e clínicos, para ajudar a utilizar todo o seu potencial para o avanço de estudos biológicos e médicos.
Vunjak-Novakovic acrescentou: “Após dez anos de pesquisa sobre órgãos em chips, ainda achamos incrível que possamos modelar a fisiologia de um paciente conectando tecidos de tamanho milimétrico – o músculo cardíaco pulsante, o fígado metabolizador e o funcionamento da pele e osso que são cultivados a partir das células do paciente. Estamos entusiasmados com o potencial dessa abordagem. Ele foi projetado exclusivamente para estudos de condições sistêmicas associadas a lesões ou doenças e nos permitirá manter as propriedades biológicas de tecidos humanos projetados juntamente com sua comunicação. Um paciente de cada vez, da inflamação ao câncer!”
Publicado em 14/05/2022 13h17
Artigo original:
Estudo original:


