Encher os bolsos de um germe com ouro pode ser uma maneira prática de acabar com uma infecção. Frustrantemente, os cientistas têm lutado para transformar esse conhecimento em uma terapia antimicrobiana prática.
Pesquisadores da Southern University of Science and Technology e da Fudan University, na China, e da University of Leeds, no Reino Unido, recentemente juntaram forças para reembalar nanoclusters de ouro para torná-los mais atraentes para as bactérias e menos danosos para nossos próprios corpos.
Ao entrelaçar o ouro em duas moléculas com níveis contrastantes de pegajosidade eletrostática, a equipe construiu uma partícula que tem o potencial de perfurar as defesas de muitos patógenos bacterianos comuns sem se perder para prejudicar os tecidos circundantes.
À primeira vista, o ouro pode não parecer um tratamento óbvio para matar germes. Reduzido a uma poeira fina em nanoescala, este elemento pesado é capaz de causar alguns danos graves.
Uma das maneiras pelas quais as nanopartículas de ouro controlam isso é facilitando as reações químicas que liberam espécies de oxigênio capazes de danificar o DNA. Outra é interferir nas membranas celulares, tornando-as mais permeáveis a várias substâncias tóxicas, como os antibióticos. Eles também podem absorver a luz de um laser com grande eficiência, aquecendo e torrando seus arredores.
Infelizmente, essas maneiras úteis de limpar infecções nem sempre distinguem as bactérias do hospedeiro, colocando nossas próprias células em risco com as terapias com nanopartículas de ouro.
O que é necessário é uma forma de encorajar as bactérias a coletar o máximo de ouro que puderem, garantindo que nossas próprias células não façam o mesmo.
Nos últimos anos, os engenheiros manipularam o comportamento das nanopartículas de ouro de duas maneiras.
Uma é controlar precisamente seu tamanho. Manter as partículas abaixo de dois nanômetros ajuda as partículas a deslizarem por nossos rins melhor, tornando a saída mais rápida de nossos corpos. Portanto, os pesquisadores se concentraram em limitar o tamanho de seus clusters a apenas 25 átomos.
O segundo é incorporar estruturas químicas ‘pegajosas’ chamadas ligantes, conferindo vários recursos que permitem que sejam facilmente rastreados ou ajudam a controlar a forma da partícula.
Nesse caso, ao aplicar um ligante com carga positiva aos aglomerados, a equipe esperava que as células bacterianas com carga mais negativa atraíssem o ouro como um suéter atrai pelos de gato.
Ajustar ainda mais as partículas para torná-las ainda menos propensas a impactar o corpo do hospedeiro ajudaria muito a transformar a terapia do ouro em uma realidade clínica. Mas estudos anteriores tiveram pouca sorte em limitar nanopartículas de ouro com algo mais do que um ligante de tipo único, já que os métodos para integrar ligantes com talentos diferentes tendem a ser incompatíveis.
Desta vez, a equipe teve uma fórmula vencedora, baseada em uma combinação de um composto carregado positivamente chamado piridínio e um zwitterion, um composto que possui grupos carregados positivamente e negativamente.
O piridínio ajuda a tornar o ouro mais atraente para as bactérias. O zwitterion foi escolhido com base em estudos anteriores que mostraram estabilidade aprimorada e compatibilidade aumentada com tecidos animais.
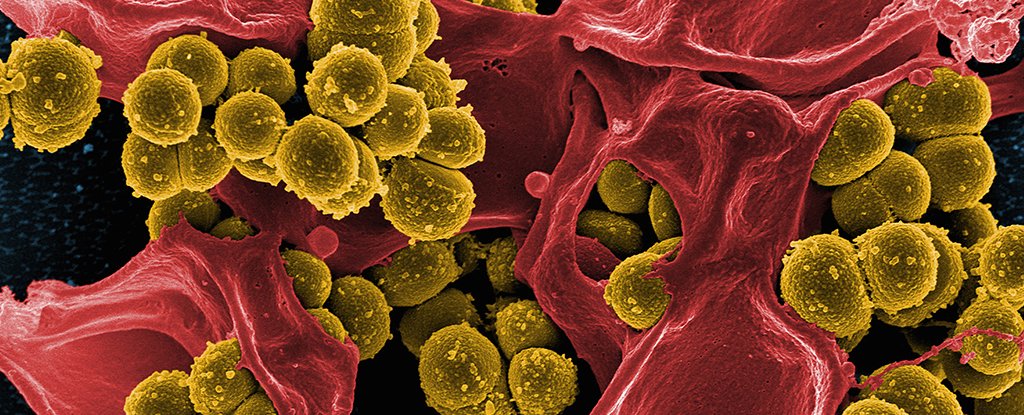
Testado em Staphylococcus epidermidis resistente à meticilina (MRSE), os nanoaglomerados de ouro aumentados tiveram um impacto claro na capacidade de agregação da bactéria. Também gerou espécies reativas de oxigênio e afetou a integridade de suas membranas.
Melhor ainda, quando recebeu vários antibióticos, o número da bactéria caiu. Em um caso, a dose necessária para inibir o crescimento do MRSE diminuiu mais de 100 vezes.
Testes em ratos com infecções de pele por MRSE ajudaram a afirmar que as nanopartículas de ouro auxiliam na cura sem ficar por perto para se tornar um incômodo.
“Ajustando sistematicamente a proporção dos dois ligantes, identificamos uma maneira de usar nanoclusters de ouro não apenas para atuar como agentes antimicrobianos eficazes, mas como um mecanismo para aumentar a potência dos antibióticos que se tornaram ineficazes devido à resistência bacteriana aos medicamentos”. diz Dejian Zhou, engenheiro químico de Leeds.
“A pesquisa tem uma importância na maneira como devemos pensar sobre como responder à resistência antimicrobiana.”
O aumento da resistência aos antibióticos é um dos problemas mais urgentes da medicina moderna, ameaçando tornar inúteis algumas de nossas defesas mais valiosas contra infecções.
Encontrar novas maneiras de matar bactérias é muito bom. Mas encontrar maneiras de manter nosso tesouro de tratamentos existentes também seria um grande alívio.
Isso poderia ser, literalmente, uma oportunidade de ouro para nos dar uma segunda chance de proteção contra doenças que ceifaram tantas vidas ao longo da história.
Publicado em 14/11/2021 23h21
Artigo original:
Estudo original:


