Centenas de cientistas trabalharam em vacinas de mRNA por décadas antes que a pandemia de coronavírus trouxesse um grande avanço.
No final de 1987, Robert Malone realizou uma experiência marcante. Ele misturou fios de RNA mensageiro com gotículas de gordura, para criar uma espécie de ensopado molecular. As células humanas banhadas neste gumbo genético absorveram o mRNA e começaram a produzir proteínas a partir dele.
Percebendo que essa descoberta pode ter um potencial de longo alcance na medicina, Malone, um estudante de graduação no Instituto Salk de Estudos Biológicos em La Jolla, Califórnia, mais tarde fez algumas anotações, que assinou e datou. Se as células pudessem criar proteínas a partir do mRNA entregue a elas, escreveu ele em 11 de janeiro de 1988, seria possível “tratar o RNA como uma droga”. Outro membro do laboratório Salk também assinou as notas para a posteridade. Mais tarde naquele ano, os experimentos de Malone mostraram que embriões de rã absorviam tal mRNA. Foi a primeira vez que alguém usou gotículas de gordura para facilitar a passagem do mRNA para um organismo vivo.
Esses experimentos foram um trampolim para duas das vacinas mais importantes e lucrativas da história: as vacinas COVID-19 baseadas em mRNA, administradas a centenas de milhões de pessoas em todo o mundo. As vendas globais desses produtos devem chegar a US $ 50 bilhões somente em 2021.
Mas o caminho para o sucesso não era direto. Por muitos anos após os experimentos de Malone, que se basearam no trabalho de outros pesquisadores, o mRNA foi visto como muito instável e caro para ser usado como uma droga ou vacina. Dezenas de laboratórios acadêmicos e empresas trabalharam na ideia, lutando para encontrar a fórmula certa de gorduras e ácidos nucléicos – os blocos de construção das vacinas de mRNA.
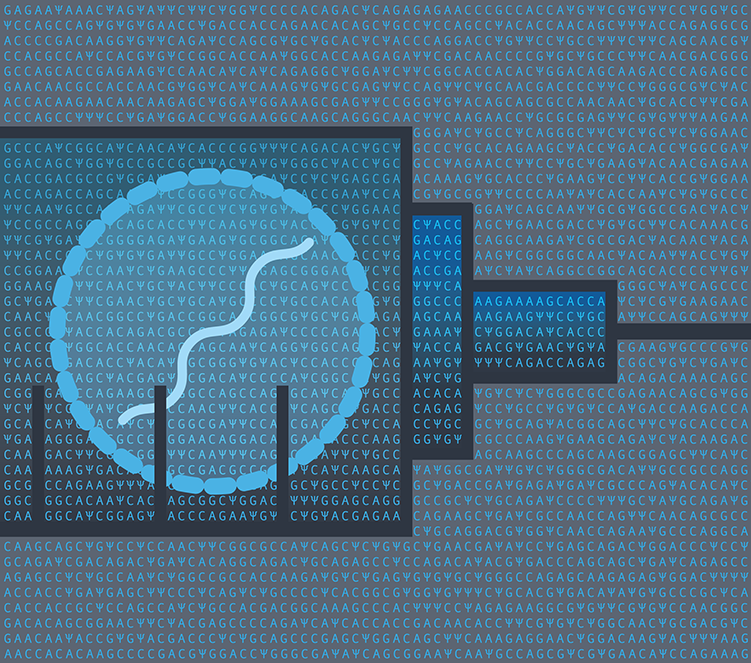
Os jabs de mRNA de hoje têm inovações que foram inventadas anos após o tempo de Malone no laboratório, incluindo RNA quimicamente modificado e diferentes tipos de bolha de gordura para transportá-los para as células (consulte ‘Dentro de uma vacina COVID de mRNA’). Ainda assim, Malone, que se autodenomina o “inventor das vacinas de mRNA”, acha que seu trabalho não recebeu crédito suficiente. “Eu fui expulso da história”, disse ele à Nature.
O debate sobre quem merece crédito por ser o pioneiro da tecnologia está esquentando conforme os prêmios começam a ser lançados – e a especulação está ficando mais intensa antes dos anúncios do prêmio Nobel no próximo mês. Mas os prêmios formais restritos a apenas alguns cientistas não reconhecerão os muitos contribuintes para o desenvolvimento médico do mRNA. Na realidade, o caminho para as vacinas de mRNA baseou-se no trabalho de centenas de pesquisadores ao longo de mais de 30 anos.
A história ilumina a maneira como muitas descobertas científicas se tornam inovações de mudança de vida: com décadas de becos sem saída, rejeições e batalhas por lucros potenciais, mas também generosidade, curiosidade e persistência obstinada contra o ceticismo e a dúvida. “É uma longa série de etapas”, diz Paul Krieg, biólogo do desenvolvimento da Universidade do Arizona em Tucson, que deu sua própria contribuição em meados da década de 1980, “e você nunca sabe o que será útil”.
O início do mRNA
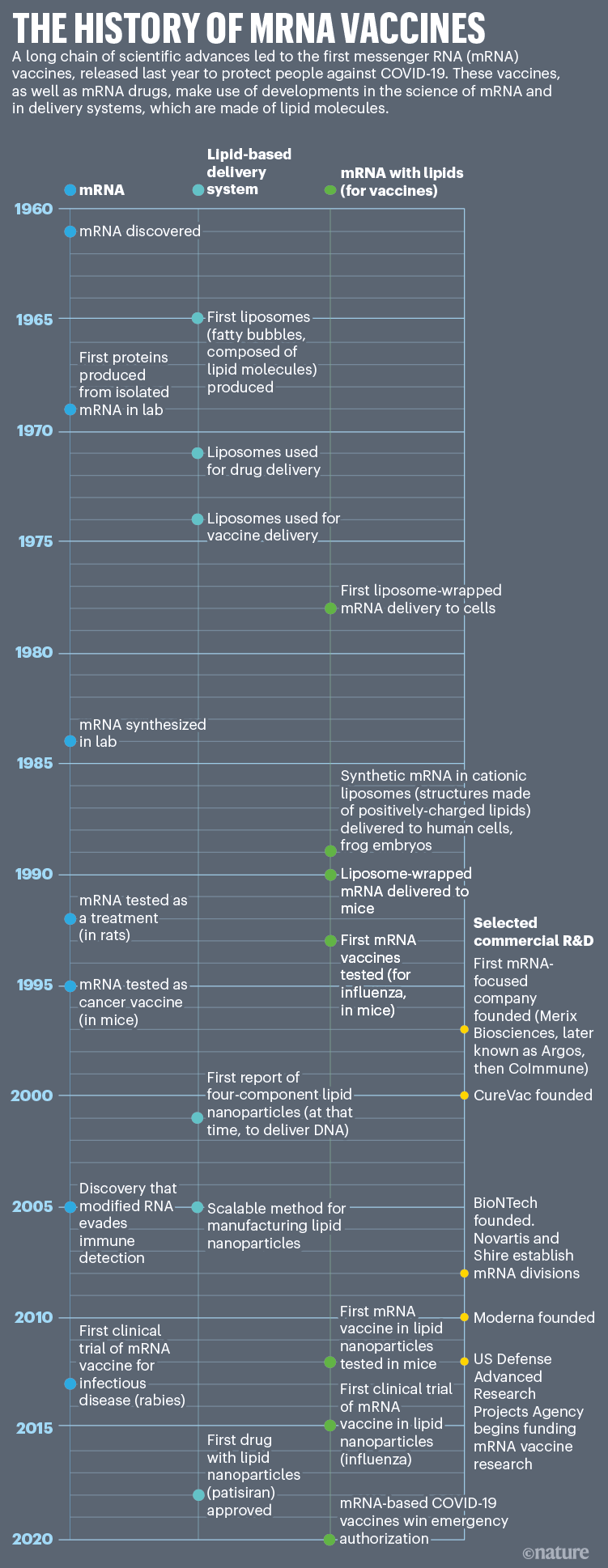
Os experimentos de Malone não surgiram do nada. Já em 1978, os cientistas usaram estruturas de membrana gordurosas chamadas lipossomas para transportar mRNA em células de ratos e humanos para induzir a expressão de proteínas. Os lipossomas empacotaram e protegeram o mRNA e depois se fundiram com as membranas celulares para entregar o material genético às células. Esses próprios experimentos foram construídos em anos de trabalho com lipossomas e com mRNA; ambos foram descobertos na década de 1960 (ver ‘A história das vacinas de mRNA’).
Naquela época, no entanto, poucos pesquisadores pensavam no mRNA como um produto médico – até porque ainda não havia uma maneira de fabricar o material genético em laboratório. Em vez disso, eles esperavam usá-lo para interrogar processos moleculares básicos. A maioria dos cientistas reaproveitou o mRNA de sangue de coelho, células de camundongos em cultura ou alguma outra fonte animal.
Isso mudou em 1984, quando Krieg e outros membros de uma equipe liderada pelo biólogo do desenvolvimento Douglas Melton e os biólogos moleculares Tom Maniatis e Michael Green da Universidade de Harvard em Cambridge, Massachusetts, usaram uma enzima de síntese de RNA (retirada de um vírus) e outras ferramentas para produzir mRNA biologicamente ativo no lab – um método que, em sua essência, continua em uso até hoje. Krieg então injetou o mRNA feito em laboratório em ovos de rã e mostrou que funcionava exatamente como a coisa real.
Tanto Melton quanto Krieg dizem que viram o mRNA sintético principalmente como uma ferramenta de pesquisa para estudar a função e a atividade dos genes. Em 1987, depois que Melton descobriu que o mRNA poderia ser usado para ativar e prevenir a produção de proteínas, ele ajudou a formar uma empresa chamada Oligogen (mais tarde renomeada Gilead Sciences em Foster City, Califórnia) para explorar maneiras de usar o RNA sintético para bloquear o expressão de genes-alvo – com vistas ao tratamento de doenças. As vacinas não estavam na mente de ninguém em seu laboratório ou de seus colaboradores.

“O RNA em geral tinha uma reputação de instabilidade inacreditável”, diz Krieg. “Tudo em torno do RNA foi envolto em cautela.” Isso pode explicar por que o escritório de desenvolvimento de tecnologia de Harvard optou por não patentear a abordagem de síntese de RNA do grupo. Em vez disso, os pesquisadores de Harvard simplesmente deram seus reagentes para a Promega Corporation, uma empresa de suprimentos de laboratório em Madison, Wisconsin, que disponibilizou as ferramentas de síntese de RNA para os pesquisadores. Eles receberam royalties modestos e uma caixa de Veuve Clicquot Champagne em troca.
Disputas de patentes
Anos depois, Malone seguiu as táticas da equipe de Harvard para sintetizar mRNA para seus experimentos. Mas ele adicionou um novo tipo de lipossoma, que carregava uma carga positiva, o que aumentou a capacidade do material de se envolver com a estrutura do mRNA carregada negativamente. Esses lipossomas foram desenvolvidos por Philip Felgner, um bioquímico que agora lidera o Centro de Pesquisa e Desenvolvimento de Vacinas da Universidade da Califórnia, em Irvine.

Apesar de seu sucesso usando os lipossomas para entregar mRNA em células humanas e embriões de rã, Malone nunca obteve um doutorado. Ele desentendeu-se com seu supervisor, o pesquisador de terapia genética Salk, Inder Verma, e, em 1989, abandonou a pós-graduação cedo para trabalhar para Felgner na Vical, uma start-up recém-formada em San Diego, Califórnia. Lá, eles e colaboradores da Universidade de Wisconsin-Madison mostraram que os complexos lipídio-mRNA podem estimular a produção de proteínas em camundongos.

Então as coisas ficaram complicadas. Tanto a Vical (com a Universidade de Wisconsin) quanto a Salk começaram a pedir patentes em março de 1989. Mas a Salk logo abandonou sua reivindicação de patente e, em 1990, Verma entrou para o conselho consultivo da Vical.
Malone afirma que Verma e Vical fecharam um acordo nos bastidores para que a propriedade intelectual relevante fosse para a Vical. Malone foi listado como um inventor entre vários, mas ele não lucraria mais pessoalmente com os acordos de licenciamento subsequentes, como teria com qualquer patente emitida pela Salk. Conclusão de Malone: “Eles ficaram ricos com os produtos da minha mente.”
Verma e Felgner negam categoricamente as acusações de Malone. “É um absurdo completo”, disse Verma à Nature. A decisão de retirar o pedido de patente ficou com o escritório de transferência de tecnologia do Salk, diz ele. (Verma renunciou ao Salk em 2018, após alegações de assédio sexual, que ele continua a negar.)
Malone deixou a Vical em agosto de 1989, citando divergências com Felgner sobre “julgamento científico” e “crédito por minhas contribuições intelectuais”. Ele concluiu a faculdade de medicina e fez um ano de treinamento clínico antes de trabalhar na academia, onde tentou continuar a pesquisa sobre vacinas de mRNA, mas lutou para garantir financiamento. (Em 1996, por exemplo, ele sem sucesso se candidatou a uma agência de pesquisa do estado da Califórnia para obter dinheiro para desenvolver uma vacina de mRNA para combater infecções sazonais por coronavírus.) Malone se concentrou em vacinas de DNA e tecnologias de distribuição.
Em 2001, ele mudou-se para trabalho comercial e consultoria. E nos últimos meses, ele começou a atacar publicamente a segurança das vacinas de mRNA que sua pesquisa ajudou a possibilitar. Malone diz, por exemplo, que as proteínas produzidas por vacinas podem danificar as células do corpo e que os riscos da vacinação superam os benefícios para crianças e adultos jovens – afirma que outros cientistas e autoridades de saúde refutaram repetidamente.
Desafios de fabricação
Em 1991, a Vical firmou um pacto de licença e colaboração de pesquisa multimilionário com a empresa norte-americana Merck, uma das maiores desenvolvedoras de vacinas do mundo. Os cientistas da Merck avaliaram a tecnologia de mRNA em camundongos com o objetivo de criar uma vacina contra a gripe, mas abandonaram essa abordagem. “O custo e a viabilidade de fabricação apenas nos deram uma pausa”, diz Jeffrey Ulmer, um ex-cientista da Merck que agora presta consultoria a empresas sobre questões de pesquisa de vacinas.
Os pesquisadores de uma pequena empresa de biotecnologia em Estrasburgo, França, chamada Transgène, pensaram da mesma forma. Lá, em 1993, uma equipe liderada por Pierre Meulien, trabalhando com parceiros industriais e acadêmicos, foi a primeira a mostrar que um mRNA em um lipossoma poderia eliciar uma resposta imune antiviral específica em camundongos. (Outro avanço empolgante ocorreu em 1992, quando cientistas do Scripps Research Institute em La Jolla usaram mRNA para substituir uma proteína deficiente em ratos, para tratar um distúrbio metabólico. Mas levaria quase duas décadas antes que laboratórios independentes relatassem sucesso semelhante.)

Os pesquisadores do Transgène patentearam sua invenção e continuaram a trabalhar em vacinas de mRNA. Mas Meulien, que agora é chefe da Innovative Medicines Initiative, uma empresa público-privada com sede em Bruxelas, estimou que precisava de pelo menos 100 milhões de Euros (US $ 119 milhões) para otimizar a plataforma – e ele não estava disposto a pedir seu patrões por isso em um empreendimento tão “complicado e de alto risco”, diz ele. A patente expirou depois que a empresa-mãe da Transgène decidiu parar de pagar as taxas necessárias para mantê-la ativa.
O grupo de Meulien, assim como a equipe da Merck, passou a se concentrar em vacinas de DNA e outros sistemas de entrega baseados em vetores. A plataforma de DNA acabou rendendo algumas vacinas licenciadas para aplicações veterinárias – ajudando, por exemplo, a prevenir infecções em fazendas de peixes. E apenas no mês passado, os reguladores na Índia concederam aprovação de emergência para a primeira vacina de DNA do mundo para uso humano, para ajudar a evitar o COVID-19. Mas, por razões que não são completamente compreendidas, as vacinas de DNA demoram a ter sucesso nas pessoas.
Ainda assim, o esforço conjunto da indústria em torno da tecnologia de DNA também trouxe benefícios para as vacinas de RNA, argumenta Ulmer. De considerações de fabricação e experiência regulatória a designs de sequências e percepções moleculares, “muitas das coisas que aprendemos com o DNA podem ser aplicadas diretamente ao RNA”, diz ele. “Ele forneceu a base para o sucesso do RNA.”
Luta contínua
Na década de 1990 e durante a maior parte dos anos 2000, quase todas as empresas de vacinas que consideraram trabalhar com mRNA optaram por investir seus recursos em outro lugar. A sabedoria convencional sustentava que o mRNA era muito sujeito à degradação e sua produção muito cara. “Foi uma luta contínua”, diz Peter Liljeström, virologista do Instituto Karolinska em Estocolmo, que há 30 anos foi o pioneiro em um tipo de vacina de RNA ‘autoamplificadora’.
“Era tão difícil trabalhar com o RNA”, diz Matt Winkler, que fundou uma das primeiras empresas de suprimentos de laboratório com foco em RNA, Ambion, em Austin, Texas, em 1989. “Se você tivesse me perguntado naquela época, se poderia injetar RNA em alguém para uma vacina, eu teria rido da sua cara. ”
A ideia da vacina de mRNA teve uma recepção mais favorável nos círculos oncológicos, embora como um agente terapêutico, ao invés de prevenir doenças. Começando com o trabalho do terapeuta genético David Curiel, vários cientistas acadêmicos e empresas iniciantes exploraram se o mRNA poderia ser usado para combater o câncer. Se o mRNA codificasse proteínas expressas por células cancerosas, pensava-se, então, injetá-lo no corpo poderia treinar o sistema imunológico para atacar essas células.
Curiel, agora na Escola de Medicina da Universidade de Washington em St Louis, Missouri, teve algum sucesso em ratos10. Mas quando ele abordou Ambion sobre as oportunidades de comercialização, diz ele, a empresa lhe disse: “Não vemos nenhum potencial econômico nesta tecnologia”.
Outro imunologista do câncer teve mais sucesso, o que levou à fundação da primeira empresa de terapia de mRNA, em 1997. Eli Gilboa propôs tirar células do sistema imunológico do sangue e persuadi-las a absorver mRNA sintético que codificava proteínas tumorais. As células seriam então injetadas de volta no corpo, onde poderiam comandar o sistema imunológico para atacar os tumores à espreita.
Gilboa e seus colegas do Duke University Medical Center em Durham, Carolina do Norte, demonstraram isso em ratos. No final da década de 1990, colaboradores acadêmicos lançaram testes em humanos e o spin-off comercial de Gilboa, Merix Bioscience (mais tarde renomeado para Argos Therapeutics e agora chamado de CoImmune), logo seguido com seus próprios estudos clínicos. A abordagem parecia promissora até alguns anos atrás, quando uma vacina candidata de estágio avançado falhou em um grande ensaio; agora está em grande parte fora de moda.
Mas o trabalho de Gilboa teve uma consequência importante. Ele inspirou os fundadores das empresas alemãs CureVac e BioNTech – duas das maiores empresas de mRNA existentes hoje – a começar a trabalhar com mRNA. Tanto Ingmar Hoerr, da CureVac, como Ugur Sahin, da BioNTech, disseram à Nature que, depois de saberem o que Gilboa tinha feito, queriam fazer o mesmo, mas administrando mRNA diretamente no corpo.

“Houve um efeito de bola de neve”, diz Gilboa, agora na Escola de Medicina Miller da Universidade de Miami, na Flórida.
Acelerador de inicialização
Hoerr foi o primeiro a alcançar o sucesso. Enquanto estava na Universidade de Tübingen, na Alemanha, ele relatou em 2000 que as injeções diretas poderiam provocar uma resposta imunológica em camundongos. Ele criou a CureVac (também com sede em Tübingen) naquele ano. Mas poucos cientistas ou investidores pareceram interessados. Em uma conferência em que Hoerr apresentou os primeiros dados do mouse, ele diz: “havia um ganhador do Prêmio Nobel de pé na primeira fileira dizendo:’ Isso é uma merda completa o que você está nos dizendo aqui – uma merda completa’.” (Hoerr se recusou a nomear o ganhador do Prêmio Nobel.)
Eventualmente, o dinheiro gotejou. E dentro de alguns anos, os testes em humanos começaram. O diretor científico da empresa na época, Steve Pascolo, foi o primeiro sujeito do estudo: ele se injetou com mRNA e ainda tem cicatrizes brancas do tamanho de uma cabeça de fósforo na perna, de onde um dermatologista tirou biópsias para análise. Um ensaio mais formal, envolvendo mRNA específico de tumor para pessoas com câncer de pele, foi iniciado logo depois.
Sahin e sua esposa imunologista, Özlem Türeci, também começaram a estudar o mRNA no final da década de 1990, mas esperaram mais do que Hoerr para abrir uma empresa. Eles usaram a tecnologia por muitos anos, trabalhando na Universidade Johannes Gutenberg Mainz, na Alemanha, ganhando patentes, trabalhos e bolsas de pesquisa, antes de apresentar um plano comercial para investidores bilionários em 2007. “Se funcionar, será inovador, “Sahin disse. Ele conseguiu 150 milhões de Euros em capital inicial.

No mesmo ano, uma empresa iniciante de mRNA chamada RNARx recebeu uma quantia mais modesta: $ 97.396 em subsídios para pequenas empresas do governo dos Estados Unidos. Os fundadores da empresa, o bioquímico Katalin Karikó e o imunologista Drew Weissman, ambos na Universidade da Pensilvânia (UPenn) na Filadélfia, fizeram o que alguns agora dizem ser uma descoberta importante: a alteração de parte do código do mRNA ajuda o mRNA sintético a escapar do defesas imunológicas inatas da célula.
Percepções fundamentais
Karikó trabalhou no laboratório durante os anos 1990 com o objetivo de transformar o mRNA em uma plataforma de medicamentos, embora as agências de financiamento continuassem recusando seus pedidos de financiamento. Em 1995, após repetidas rejeições, ela teve a opção de deixar a UPenn ou aceitar um rebaixamento e corte de pagamento. Ela optou por ficar e continuar sua busca obstinada, fazendo melhorias nos protocolos de Malone e conseguindo induzir as células a produzir uma proteína grande e complexa de relevância terapêutica.

Em 1997, ela começou a trabalhar com Weissman, que havia acabado de iniciar um laboratório na UPenn. Juntos, eles planejaram desenvolver uma vacina baseada em mRNA para HIV / AIDS. Mas os mRNAs de Karikó desencadearam reações inflamatórias massivas quando foram injetados em camundongos.
Ela e Weissman logo descobriram o porquê: o mRNA sintético estava despertando uma série de sensores imunológicos conhecidos como receptores Toll-like, que atuam como primeiros respondedores aos sinais de perigo dos patógenos. Em 2005, a dupla relatou que reorganizar as ligações químicas em um dos nucleotídeos do mRNA, a uridina, para criar um análogo chamado pseudouridina, parecia impedir o corpo de identificar o mRNA como um inimigo.

Poucos cientistas na época reconheceram o valor terapêutico desses nucleotídeos modificados. Mas o mundo científico logo despertou para seu potencial. Em setembro de 2010, uma equipe liderada por Derrick Rossi, um biólogo de células-tronco do Boston Children’s Hospital em Massachusetts, descreveu como os mRNAs modificados poderiam ser usados para transformar células da pele, primeiro em células-tronco embrionárias e depois em contração de tecido muscular. A descoberta causou impacto. Rossi foi destaque na revista Time como uma das ‘pessoas que importavam’ em 2010. Ele co-fundou uma start-up, Moderna em Cambridge.
Moderna tentou licenciar as patentes para mRNA modificado que UPenn havia apresentado em 2006 para a invenção de Karikó e Weissman. Mas era tarde demais. Depois de não conseguir chegar a um acordo de licenciamento com a RNARx, a UPenn optou por um pagamento rápido. Em fevereiro de 2010, concedeu direitos de patente exclusivos a um pequeno fornecedor de reagentes de laboratório em Madison. Agora chamada de Cellscript, a empresa pagou US $ 300.000 no negócio. Isso geraria centenas de milhões de dólares em taxas de sublicenciamento da Moderna e da BioNTech, os criadores das primeiras vacinas de mRNA para COVID-19. Ambos os produtos contêm mRNA modificado.
A RNARx, por sua vez, usou outros $ 800.000 em subsídios para pequenas empresas e encerrou as operações em 2013, na época em que Karikó ingressou na BioNTech (mantendo uma nomeação adjunta na UPenn).
O debate da pseudouridina
Os pesquisadores ainda discutem se a descoberta de Karikó e Weissman é essencial para o sucesso de vacinas de mRNA. Moderna sempre usou mRNA modificado – seu nome é uma combinação dessas duas palavras. Mas alguns outros na indústria não o fizeram.
Pesquisadores da divisão de terapias genéticas humanas da empresa farmacêutica Shire em Lexington, Massachusetts, raciocinaram que o mRNA não modificado poderia render um produto que era tão eficaz se as estruturas de ‘cobertura’ corretas fossem adicionadas e todas as impurezas fossem removidas. “Tudo se resumia à qualidade do RNA”, diz Michael Heartlein, que liderou o esforço de pesquisa da Shire e continuou a desenvolver a tecnologia na Translate Bio em Cambridge, para a qual a Shire posteriormente vendeu seu portfólio de mRNA. (Shire agora faz parte da empresa japonesa Takeda.)
Embora a Translate tenha alguns dados humanos que sugerem que seu mRNA não provoca uma resposta imune preocupante, sua plataforma ainda precisa ser provada clinicamente: sua vacina candidata COVID-19 ainda está nos primeiros testes em humanos. Mas a gigante farmacêutica francesa Sanofi está convencida da promessa da tecnologia: em agosto de 2021, ela anunciou planos de adquirir a Translate por US $ 3,2 bilhões. (Heartlein saiu no ano passado para fundar outra empresa em Waltham, Massachusetts, chamada Maritime Therapeutics.)
O CureVac, por sua vez, tem sua própria estratégia de imunomitigação, que envolve alterar a sequência genética do mRNA para minimizar a quantidade de uridina em suas vacinas. Vinte anos de trabalho nessa abordagem pareciam estar dando frutos, com os primeiros testes das vacinas experimentais da empresa contra a raiva e COVID-19 sendo ambos um sucesso. Mas em junho, os dados de um ensaio em estágio posterior mostraram que a vacina candidata do CureVac contra o coronavírus era muito menos protetora do que a da Moderna ou da BioNTech.
À luz desses resultados, alguns especialistas em mRNA agora consideram a pseudouridina um componente essencial da tecnologia – e então, eles dizem, a descoberta de Karikó e Weissman foi uma das principais contribuições habilitadoras que merece reconhecimento e prêmios. “O verdadeiro vencedor aqui é o RNA modificado”, diz Jake Becraft, cofundador e executivo-chefe da Strand Therapeutics, uma empresa de biologia sintética sediada em Cambridge que trabalha com terapias baseadas em mRNA.
Nem todo mundo tem tanta certeza. “Existem vários fatores que podem afetar a segurança e eficácia de uma vacina de mRNA, a modificação química do mRNA é apenas um deles”, disse Bo Ying, executivo-chefe da Suzhou Abogen Biosciences, uma empresa chinesa com uma vacina de mRNA para COVID-19 agora em testes clínicos de estágio final. (Conhecido como ARCoV, o produto usa mRNA não modificado.)
Descoberta de gordura
Quanto às tecnologias fundamentais, muitos especialistas destacam outra inovação que foi crucial para as vacinas de mRNA – uma que não tem nada a ver com o mRNA. São as pequenas bolhas de gordura conhecidas como nanopartículas lipídicas, ou LNPs, que protegem o mRNA e o transportam para as células.
Essa tecnologia vem do laboratório de Pieter Cullis, bioquímico da University of British Columbia em Vancouver, Canadá, e de várias empresas que fundou ou liderou. Começando no final da década de 1990, eles foram os pioneiros dos LNPs na entrega de fitas de ácidos nucléicos que silenciam a atividade do gene. Um desses tratamentos, o patisiran, está agora aprovado para uma doença hereditária rara.

Depois que a terapia de silenciamento de genes começou a se mostrar promissora em testes clínicos, em 2012, duas das empresas de Cullis se empenharam para explorar oportunidades para o sistema de entrega de LNP em medicamentos baseados em mRNA. A Acuitas Therapeutics em Vancouver, por exemplo, liderada pelo executivo-chefe Thomas Madden, formou parcerias com o grupo de Weissman na UPenn e com várias empresas de mRNA para testar diferentes formulações de mRNA-LNP. Um deles agora pode ser encontrado nas vacinas COVID-19 da BioNTech e CureVac. A mistura LNP da Moderna não é muito diferente.
As nanopartículas possuem uma mistura de quatro moléculas de gordura: três contribuem para a estrutura e estabilidade; o quarto, chamado de lipídio ionizável, é a chave para o sucesso do LNP. Essa substância tem carga positiva em condições de laboratório, o que oferece vantagens semelhantes aos lipossomas que Felgner desenvolveu e Malone testou no final dos anos 1980. Mas os lipídios ionizáveis desenvolvidos por Cullis e seus parceiros comerciais se convertem em uma carga neutra em condições fisiológicas como as da corrente sanguínea, o que limita os efeitos tóxicos no corpo.
Além disso, o coquetel de quatro lipídios permite que o produto seja armazenado por mais tempo na prateleira da farmácia e mantenha sua estabilidade dentro do corpo, diz Ian MacLachlan, ex-executivo de vários empreendimentos ligados a Cullis. “É todo o kit e caboodle que leva à farmacologia que temos agora”, diz ele.

Em meados dos anos 2000, uma nova maneira de misturar e fabricar essas nanopartículas foi concebida. Envolveu o uso de um aparelho de “conector T”, que combina gorduras (dissolvidas em álcool) com ácidos nucleicos (dissolvidos em um tampão ácido). Quando os fluxos das duas soluções se fundiram, os componentes formaram espontaneamente LNPs densamente compactados. Provou ser uma técnica mais confiável do que outras maneiras de fazer medicamentos baseados em mRNA.
Depois que todas as peças se juntaram, “era como fumaça sagrada, finalmente temos um processo que podemos escalar”, diz Andrew Geall, agora diretor de desenvolvimento da Replicate Bioscience em San Diego. Geall liderou a primeira equipe a combinar LNPs com uma vacina de RNA, no hub da Novartis nos EUA em Cambridge em 2012. Cada empresa de mRNA agora usa alguma variação desta plataforma de entrega de LNP e sistema de fabricação – embora quem possui as patentes relevantes continue a ser objeto de disputa legal . A Moderna, por exemplo, está travando uma batalha com uma empresa afiliada à Cullis – a Arbutus Biopharma em Vancouver – sobre quem detém os direitos da tecnologia LNP encontrada no jab COVID-19 da Moderna.
Nasce uma indústria
No final dos anos 2000, várias grandes empresas farmacêuticas estavam entrando no campo do mRNA. Em 2008, por exemplo, tanto a Novartis quanto a Shire estabeleceram unidades de pesquisa de mRNA – a primeira (liderada por Geall) focada em vacinas, a última (liderada por Heartlein) em terapêutica. A BioNTech foi lançada naquele ano, e outras start-ups logo entraram na briga, amparadas por uma decisão de 2012 da Agência de Projetos de Pesquisa Avançada de Defesa dos Estados Unidos de começar a financiar pesquisadores da indústria para estudar vacinas e medicamentos de RNA. A Moderna foi uma das empresas que se basearam nesse trabalho e, em 2015, arrecadou mais de US $ 1 bilhão com a promessa de aproveitar o mRNA para induzir as células do corpo a fazer seus próprios medicamentos – corrigindo assim doenças causadas por proteínas ausentes ou defeituosas . Quando esse plano vacilou, a Moderna, liderada pelo presidente-executivo Stéphane Bancel, optou por priorizar uma meta menos ambiciosa: fabricar vacinas.

Isso inicialmente decepcionou muitos investidores e curiosos, porque uma plataforma de vacina parecia ser menos transformadora e lucrativa. No início de 2020, a Moderna havia avançado nove candidatos a vacinas de mRNA para doenças infecciosas em pessoas para teste. Nenhum foi um sucesso absoluto. Apenas um havia progredido para um teste de fase maior.
Mas quando o COVID-19 atacou, a Moderna saiu rapidamente do alvo, criando um protótipo de vacina poucos dias após a sequência do genoma do vírus se tornar disponível online. A empresa então colaborou com o Instituto Nacional de Alergia e Doenças Infecciosas dos Estados Unidos (NIAID) para conduzir estudos em ratos e lançar testes em humanos, tudo em menos de dez semanas.
A BioNTech também adotou uma abordagem totalmente prática. Em março de 2020, fez parceria com a empresa farmacêutica Pfizer, sediada em Nova York, e os testes clínicos avançaram em um ritmo recorde, indo do primeiro teste em humanos à aprovação de emergência em menos de oito meses.
Ambas as vacinas autorizadas usam mRNA modificado formulado em LNPs. Ambos também contêm sequências que codificam uma forma da proteína spike SARS-CoV-2 que adota uma forma mais adequada para induzir imunidade protetora. Muitos especialistas dizem que o ajuste de proteína, planejado pelo vacinologista do NIAID Barney Graham e os biólogos estruturais Jason McLellan da Universidade do Texas em Austin e Andrew Ward em Scripps, também é uma contribuição digna de prêmio, embora seja específica para vacinas contra o coronavírus, não A vacinação de mRNA como plataforma geral.
Parte do furor nas discussões sobre crédito para descobertas de mRNA diz respeito a quem detém patentes lucrativas. Mas grande parte da propriedade intelectual fundamental remonta a reivindicações feitas em 1989 por Felgner, Malone e seus colegas na Vical (e em 1990 por Liljeström). Eles tinham prazo de apenas 17 anos a partir da data de emissão e, portanto, agora estão no domínio público.
Mesmo as patentes Karikó-Weissman, licenciadas para a Cellscript e depositadas em 2006, irão expirar nos próximos cinco anos. Especialistas da indústria dizem que isso significa que em breve ficará muito difícil patentear amplas reivindicações sobre a entrega de mRNAs em nanopartículas de lipídios, embora as empresas possam patentear sequências particulares de mRNA – uma forma da proteína spike, digamos – ou formulações lipídicas proprietárias.
As empresas estão tentando. Moderna, o jogador dominante no campo da vacina de mRNA, que tem injeções experimentais em testes clínicos para gripe, citomegalovírus e uma série de outras doenças infecciosas, obteve duas patentes no ano passado cobrindo o amplo uso de mRNA para produzir proteínas secretadas. Mas vários membros da indústria disseram à Nature que eles acham que isso pode ser desafiado.
“Não sentimos que haja muito que seja patenteável e certamente não aplicável”, disse Eric Marcusson, diretor científico da Providence Therapeutics, uma empresa de vacinas de mRNA em Calgary, Canadá.
Debate Nobel
Quanto a quem merece um Nobel, os nomes que mais aparecem nas conversas são Karikó e Weissman. Os dois já ganharam vários prêmios, incluindo um dos Prêmios Revelação (de US $ 3 milhões, o prêmio mais lucrativo da ciência) e o prestigioso Prêmio da Princesa das Astúrias para Pesquisa Técnica e Científica da Espanha. Também foram reconhecidos no prêmio Astúrias Felgner, Sahin, Türeci e Rossi, junto com Sarah Gilbert, a vacinologista por trás da vacina COVID-19 desenvolvida pela Universidade de Oxford, no Reino Unido, e a empresa farmacêutica AstraZeneca, que usa um vetor viral em vez de mRNA. (O único prêmio recente de Cullis foi um prêmio de fundador de US $ 5.000 da Sociedade de Liberação Controlada, uma organização profissional de cientistas que estudam drogas de liberação controlada.)
Alguns também argumentam que Karikó deve ser reconhecida tanto por suas contribuições para a comunidade de pesquisa de mRNA em geral quanto por suas descobertas no laboratório. “Ela não é apenas uma cientista incrível, ela é apenas uma força no campo”, diz Anna Blakney, bioengenheira de RNA da Universidade de British Columbia. Blakney dá crédito a Karikó por oferecer a ela um espaço para falar em uma grande conferência há dois anos, quando ela ainda estava em uma posição de pós-doutorado júnior (e antes de Blakney ter co-fundado a VaxEquity, uma empresa de vacinas em Cambridge, Reino Unido, com foco na auto-amplificação Tecnologia de RNA). Karikó “está ativamente tentando erguer outras pessoas em uma época em que ela foi tão pouco reconhecida em toda a sua carreira”.
Embora alguns envolvidos no desenvolvimento do mRNA, incluindo Malone, pensem que merecem mais reconhecimento, outros estão mais dispostos a compartilhar os holofotes. “Você realmente não pode reivindicar o crédito”, diz Cullis. Quando se trata de seu sistema de entrega de lipídios, por exemplo, “estamos falando de centenas, provavelmente milhares de pessoas que têm trabalhado juntas para fazer esses sistemas LNP para que eles estejam realmente prontos para o horário nobre.”
“Todos apenas adicionaram algo – inclusive eu”, diz Karikó.
Olhando para trás, muitos dizem que estão simplesmente maravilhados com o fato de as vacinas de mRNA estarem fazendo a diferença para a humanidade e que podem ter feito uma contribuição valiosa ao longo do caminho. “É emocionante para mim ver isso”, diz Felgner. “Todas as coisas que pensávamos que aconteceriam naquela época – está acontecendo agora.”
Publicado em 15/09/2021 19h10
Artigo original:
Estudo original:


