No início, ninguém entendia realmente como os bebês eram feitos. Os pensadores ficaram intrigados durante milênios sobre como a vida surgia de uma geração para a outra. Mas foi só no século 17 que os cientistas começaram a estudar seriamente a questão. Naquela época, a teoria da pré-formação sustentava que humanos minúsculos já existiam, totalmente formados, no sangue menstrual da mãe ou no sêmen do pai, dependendo se você era um “ovista” ou um “espermista”.
Poucas coisas mudaram até que dois cientistas do final do século 19, Oskar Hertwig da Alemanha e Hermann Fol da França, conduziram experiências com ouriços-do-mar de forma independente, provando conclusivamente que a criação de uma nova prole requer um óvulo e um espermatozóide.
Apesar da confusão inicial, os antigos tinham certeza de uma coisa: a reprodução está longe de ser uma aposta certa. Hoje, cerca de 15 por cento dos casais em todo o mundo são incapazes de conceber um filho naturalmente, levando a sentimentos de tristeza, perda e um profundo sentimento de inadequação para muitos. Um século atrás, a ciência não tinha muito a oferecer a esses casais.
A única intervenção de fertilidade amplamente disponível em 1921 era a inseminação artificial por esperma de um doador, que era moral e legalmente carregada. Na primeira metade do século 20, a prática era frequentemente considerada uma forma de adultério; ainda em 1963, um tribunal de Illinois decidiu que um bebê concebido desta forma, mesmo com o consentimento do marido, era ilegítimo.
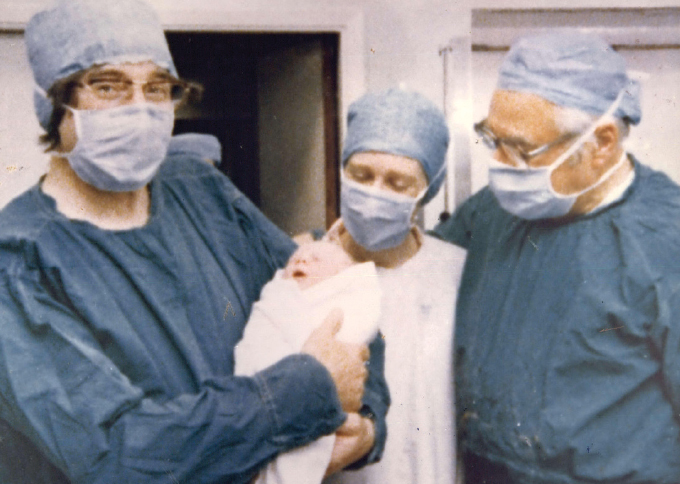
Em 1978, tudo mudou. O nascimento de Louise Brown, o primeiro “bebê de proveta” do mundo, provou que os casais inférteis tinham outra opção: a fertilização in vitro. A técnica envolvia remover um óvulo maduro da mãe, misturá-lo em uma placa de laboratório com o esperma do pai e deixar o óvulo fertilizado, chamado zigoto, crescer por alguns dias. O zigoto era então devolvido ao útero da mãe, onde poderia se implantar e crescer em uma gravidez normal.
Desde o nascimento histórico de Brown, os cientistas desenvolveram uma série de maneiras de dar um impulso à Mãe Natureza na criação de bebês. Os vários métodos são conhecidos coletivamente como tecnologia de reprodução assistida ou ART. Cerca de 9 milhões de bebês em todo o mundo nasceram usando versões de ART.
O impacto foi tão profundo sociologicamente quanto médico. Agora que a ART se tornou quase uma rotina, muitas das primeiras reclamações sobre os cientistas brincando de Deus e manipulando a vida desapareceram. A paternidade agora é possível para pessoas que nunca a imaginaram em seus futuros, incluindo casais do mesmo sexo e pais solteiros, graças a refinamentos como doadores de óvulos, barriga de aluguel e congelamento bem-sucedido de óvulos, espermatozoides e embriões. E tudo isso começa, como a própria vida humana começa, com o ovo.
Mão amiga
A tecnologia de reprodução assistida, ou ART, oferece várias abordagens para ajudar as pessoas a terem filhos. As técnicas de ART são mais populares na Europa.
Procedimentos de tecnologia reprodutiva assistida por ano, 1997-2016:
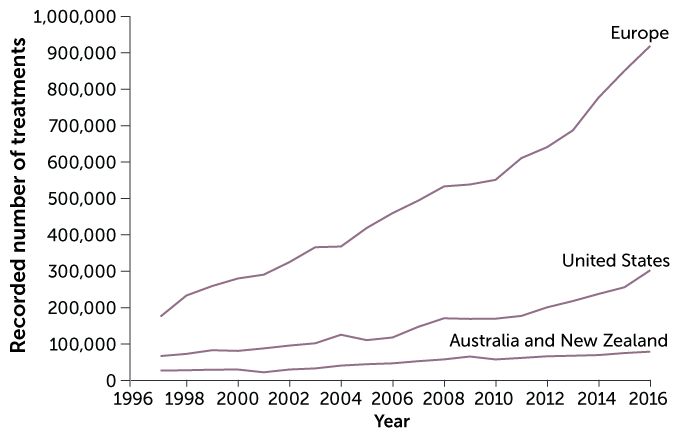
FONTE: C. DE GEYTER ET AL / REPRODUÇÃO HUMANA 2020
Ovos bons
Mesmo os cientistas não podem fazer bebês sem ovos. Normalmente, uma mulher produz apenas um óvulo maduro por mês, e a qualidade de seus óvulos tende a diminuir quando ela chega aos 30 anos. Portanto, a capacidade dos pesquisadores de recuperar e preparar este recurso escasso para fertilização e, se necessário, preservar os óvulos por congelamento, tem sido crucial para auxiliar a reprodução.
As mulheres têm dois ovários, cada um contendo milhares de folículos óvulos imaturos. Durante os anos de procriação, os ovários geralmente liberam óvulos maduros em rotação: um único óvulo maduro que rola do ovário direito em um ciclo menstrual, e do ovário esquerdo no próximo.
Mas as mulheres que usam TARV geralmente dependem de injeções de vários hormônios da fertilidade para fazer o processo funcionar. Essas injeções permitirão que ovários lentos produzam óvulos que podem ser fertilizados por meio de relações sexuais ou no laboratório por fertilização in vitro. Para a fertilização in vitro, os candidatos de aparência mais robusta são escolhidos para implantar ou congelar para uso posterior. Essa primeira etapa na ART, ao que parece, também é uma das mais complicadas: escolher os hormônios certos para obter os óvulos de que você precisa.
O conhecimento sobre os hormônios e como eles afetam a ovulação remonta a 1923, quando os cientistas Edgar Allen e Edward Doisy, da Escola de Medicina da Universidade de Washington, em St. Louis, isolaram pela primeira vez o estrogênio em camundongos e ratos experimentais e descobriram que ele era produzido nos ovários. Na década de 1940, os cientistas elucidaram os fluxos e refluxos de outros hormônios em animais de laboratório e humanos – hormônio folículo estimulante, hormônio luteinizante e gonadotrofina coriônica humana – ao longo de um ciclo menstrual típico.
A TARV geralmente começa com uma mulher administrando a si mesma injeções diárias contendo um coquetel desses hormônios, geralmente por 10 a 14 dias. Mas para algumas mulheres que querem ter filhos, mas estão lidando com um diagnóstico de câncer, as injeções de hormônio não são uma opção – e o tempo está passando. Eles precisam iniciar o tratamento do câncer o mais rápido possível, mas muitos dos tratamentos podem danificar o sistema reprodutor.
Para preservar sua fertilidade, essas mulheres podem optar por congelar seus óvulos antes do tratamento contra o câncer. Mas eles podem não ter 10 dias ou mais para esperar até que as injeções de hormônio façam seus ovários produzirem óvulos extras – nem podem tomar os medicamentos em primeiro lugar se tiverem um câncer sensível aos hormônios, como alguns cânceres de mama , que os medicamentos estimuladores da ovulação podem piorar. Portanto, para essas mulheres, os pesquisadores tiveram que encontrar maneiras de amadurecer um monte de óvulos de uma só vez e fora do corpo – uma técnica conhecida como maturação in vitro.
A maturação in vitro foi usada pela primeira vez em 1934, quando os pesquisadores de Harvard Gregory Pincus e E.V. Enzmann o usou em coelhos. Os dois cientistas cultivaram ovos de coelho imaturos por cerca de um dia, suplementando o caldo nutriente com extratos das glândulas pituitárias de vaca ou com um “hormônio da maturidade” não especificado. Ambos os suplementos ajudaram os ovos imaturos a crescerem até a maturidade, momento em que foram fertilizados com sucesso.
Em 1940, Pincus foi questionado por um repórter do New York Times qual poderia ser o próximo grande desenvolvimento na ciência reprodutiva. “Não existem grandes passos, existem pequenos passos”, disse ele, recusando-se a fazer quaisquer previsões. Tudo o que ele sabia com certeza, disse ele, era que as “grandes questões” do dia eram: por que um ovo começa a se desenvolver e por que continua a se desenvolver?

Quando os endocrinologistas reprodutivos recuperam óvulos de seus pacientes com TARV, após estimular os ovários por meio de injeções de hormônio ou amadurecer os óvulos em laboratório, eles têm duas opções: fertilizar os óvulos e implantar o embrião imediatamente, ou armazená-los. Para as mulheres que ainda não estão prontas para ter um filho, armazenar os óvulos é a melhor opção. Isso é feito por congelamento – o que, nos primeiros dias da ART, era realmente um negócio complicado. Os ovos têm um alto teor de fluidos que os leva a formar cristais quando congelados; durante o descongelamento, esses cristais podem danificar o ovo, especialmente o delicado aparelho necessário para cortar o número de cromossomos da célula pela metade. Ao dividir os cromossomos, um óvulo e um espermatozóide podem se fundir sem dobrar a contagem de cromossomos.
Na década de 1980, o congelamento de óvulos funcionou ocasionalmente; a primeira gravidez bem-sucedida usando óvulos congelados da própria mulher, levando ao nascimento de gêmeos saudáveis, foi relatada em 1986 por Christopher Chen, da Flinders University of South Australia, em Adelaide. Mas o congelamento de óvulos ainda era uma possibilidade remota. As estimativas eram de que não mais do que 1 ou 2 por cento dos ovos descongelados resultariam em nascidos vivos.
Então, em 1999, surgiram relatórios de um método de congelamento mais confiável: a vitrificação, que congela o ovo tão rapidamente que nenhum cristal de gelo pode se formar. Uma equipe de pesquisa baseada na Austrália e na Itália descreveu experimentos com animais nos quais 1 em cada 4 óvulos de vaca vitrificados foram fertilizados e posteriormente cresceram, por volta do dia 5, até o estágio de blastocisto. Foi apenas cerca de metade da taxa alcançada para ovos de vaca frescos, mas ainda era várias vezes melhor do que a taxa para ovos congelados lentamente. Quando se trata de uso clínico, alguns pesquisadores estimam a taxa de nascidos vivos de óvulos vitrificados em cerca de 2 a 12 por cento para mulheres com menos de 38 anos.
No início, a vitrificação era limitada a pessoas que congelavam seus óvulos por motivos médicos, como câncer. Mas em 2013, a criopreservação de óvulos se tornou uma opção para quem quisesse atrasar a gravidez por qualquer motivo, médico ou não.
Em 2020, as estimativas eram de que um subconjunto crescente de mulheres que optam pela vitrificação com óvulos a cada ano nos Estados Unidos o fazem porque ainda não estão prontas para ter filhos, mas esperam ter um dia – razões relacionadas ao estilo de vida que passaram a ser conhecidas como ” congelamento social. ”
Embora o congelamento social seja frequentemente promovido como uma forma de atrasar a gravidez quase indefinidamente, a maioria das mulheres nunca retorna à clínica para usar seus óvulos congelados. Na Universidade McGill em Montreal, por exemplo, William Buckett e seus colegas descobriram que, ao longo de 13 anos, o programa de preservação da fertilidade do câncer da escola tratou 353 mulheres, das quais 9% morreram, 6% engravidaram espontaneamente e a maioria estava ainda lidando com seu câncer ou perderam contato com a clínica por razões desconhecidas. Apenas 23 mulheres, 6,5% do grupo, voltaram a McGill para usar seus óvulos congelados ou embriões. Essa baixa taxa de retorno também se aplica às mulheres que optam pelo congelamento social.
O Esperma encontra o óvulo
Comparado com o óvulo humano, o esperma é muito simples. Eles foram observados pela primeira vez em 1677, quando Antonie van Leeuwenhoek, o inventor holandês de um dos primeiros microscópios do mundo, deu uma olhada em sua própria ejaculação sob ampliação e percebeu o que chamou de “animálculos” nadando na amostra. Mas sua estrutura e função não entraram em foco até 1876, quando Hertwig observou um espermatozóide fertilizar o óvulo de um ouriço-do-mar.
Pincus e Enzmann, que foram os primeiros a trazer óvulos de mamíferos à maturidade em laboratório, usaram esperma de coelho para obter a primeira fertilização em laboratório em um mamífero em 1934.
Levou anos de luta para passar dos coelhos aos humanos. Em 1951, uma raridade no esperma fez parecer que Pincus e Enzmann tiveram sorte. As células espermáticas, ao que parecia, precisavam ser preparadas de alguma forma por meio de um processo chamado capacitação antes que pudessem perfurar o óvulo.
Robert Edwards, da Universidade de Cambridge, um dos principais investigadores mundiais em FIV durante as décadas de 1960 e 1970, pensava que a capacitação seria “um terrível obstáculo para a FIV”, lembra Roger Gosden, um embriologista que trabalhou no laboratório de Edwards e escreveu a biografia de Edwards Que haja vida. Ele se lembra de algumas tentativas frenéticas de imitar a capacitação do esperma – como quando os cientistas criaram câmaras porosas, quase do tamanho de um DIU implantado, ou dispositivo intra-uterino, usado para contracepção. Os pesquisadores encheram uma câmara com esperma e os inseriram no útero de uma voluntária, na esperança de expor o esperma a qualquer substância capacitante desconhecida existente na natureza. Depois de esperar um pouco, os cientistas puxariam um barbante preso à câmara para recuperar o espermatozóide, agora “preparado”, para ver se eles realmente haviam se tornado mais capazes de fertilizar óvulos em laboratório.
No final, os cientistas encontraram uma maneira mais fácil. “Você só precisa lavar o esperma para se livrar de alguns constituintes da superfície”, diz Gosden, e os espermatozoides estão prontos para fertilizar um óvulo em um prato de laboratório. Outras dificuldades na pesquisa clínica se mostraram mais formidáveis, como avaliar o melhor momento de retirada dos óvulos das mulheres e ajustar como os dias pós-fertilização do manbeatry eram melhores para transferir o zigoto para o útero. Edwards e seus colaboradores, incluindo o ginecologista Patrick Steptoe, tiveram mais de 300 tentativas fracassadas de fertilização in vitro antes de seu primeiro sucesso com Louise Brown em 1978 na Inglaterra. Edwards acabou ganhando o Prêmio Nobel em 2010 por suas descobertas de fertilização in vitro.
Entre as beneficiárias do trabalho pioneiro de Edwards está Claudy, que foi diagnosticada com câncer de mama aos 29 anos e que, em um século diferente, talvez nunca tivesse sido capaz de ter um filho. Claudy procurou Michaël Grynberg e seus colegas da clínica de fertilidade do Hospital da Universidade Antoine Béclère, nos arredores de Paris, para discutir maneiras de preservar sua fertilidade. Era 2014 e o congelamento de óvulos por vitrificação estava se tornando mais comum. Mas levar um ovo imaturo à maturidade em laboratório ainda era relativamente raro. Desde a época do primeiro bebê nascido de óvulos frescos amadurecidos em laboratório em 1991 até a chegada de Claudy à clínica de Grynberg, apenas cerca de 5.000 desses nascimentos ocorreram.
Mas Grynberg não teve escolha. Ele teve que recuperar óvulos imaturos de Claudy, por uma questão de velocidade e para evitar o agravamento de seu câncer de mama sensível aos hormônios com medicamentos para fertilidade. Além disso, ele teria que fazer algo sem precedentes no contexto do câncer: congelar os óvulos amadurecidos em laboratório para uso posterior. Nenhum bebê nasceu de óvulos retirados de um paciente com câncer que foram amadurecidos em laboratório e depois congelados. (Houve um bebê nascido em McGill em 2009 de uma mulher que não tinha câncer, cujos óvulos foram amadurecidos no laboratório e congelados, depois descongelados.)
Grynberg extraiu sete ovos imaturos e conseguiu crescer seis deles até a maturidade nas 48 horas seguintes. Esses seis foram congelados, enquanto Claudy fazia cirurgia e quimioterapia.
Alguns anos depois, o oncologista de Claudy disse a ela que era seguro engravidar e ela passou um ano tentando engravidar. Mas ela não fez isso. Então, em 2018, ela voltou à clínica de Grynberg, onde os médicos se prepararam para descongelar seus seis ovos congelados.
Para fertilizá-los, no caso de Claudy, era necessária uma dose adicional de ART. Como seus óvulos foram congelados, o esperma de seu parceiro precisaria de ajuda para fertilizar seus óvulos. A vitrificação causa mudanças na membrana externa do óvulo que torna o óvulo descongelado particularmente difícil de ser penetrado pelos espermatozoides. Essa membrana, chamada de zona pelúcida, é uma barreira formidável mesmo na natureza. Um dos primeiros a descrevê-lo foi Sardul Singh Guraya, biólogo da Punjab Agricultural University, na Índia, que fez seu primeiro trabalho com ratos de campo.
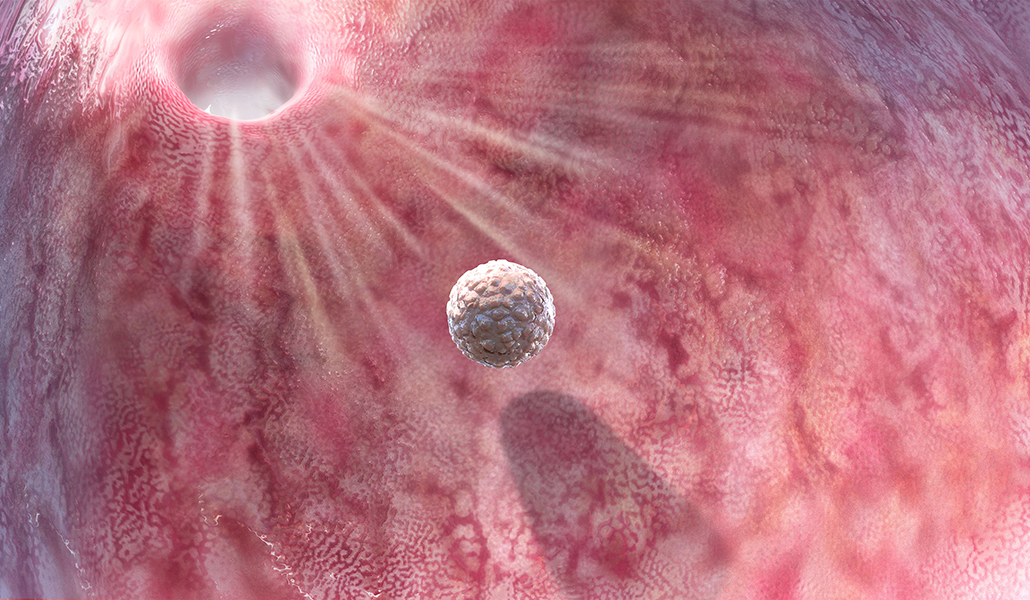
A zona pelúcida, relatou Guraya em 1978, é uma barreira ao redor do ovo feita de proteínas e carboidratos e, quando um espermatozóide a rompe, os grânulos corticais se reorganizam para bloquear todos os outros espermatozoides. Isso garante que o zigoto terá um complemento genético normal de apenas dois pares de 23 cromossomos, um da mãe e um do pai, em vez de um número muito inflado que resultaria se vários espermatozoides fertilizassem o óvulo.
Os cientistas passaram grande parte da década seguinte tentando colocar espermatozoides em óvulos que haviam sido congelados usando micromanipulações descritas com termos invasivos como “perfuração por zona”. Mas o esperma ainda não conseguiu atingir o núcleo para fertilização.
Então, em 1992, Gianpiero Palermo, um cientista italiano em licença sabática da Universidade de Bari, relatou uma descoberta acidental que fez enquanto trabalhava em um laboratório de fertilidade na Universidade Livre de Bruxelas. Quando ele tentou injetar espermatozóides suavemente abaixo da camada externa do óvulo, com cuidado para não perfurar o centro gelatinoso conhecido como citoplasma, ele percebeu que uma “covinha” ocasional na membrana permitiria que o esperma penetrasse diretamente no centro de qualquer maneira. Quando isso acontecia, o óvulo quase sempre era fertilizado. Portanto, apesar da recomendação geral de evitar isso, Palermo tentou injetar o esperma, cauda e tudo, diretamente no citoplasma.
Das primeiras 47 tentativas que Palermo e seus colegas em Bruxelas fizeram com essa abordagem, 38 óvulos permaneceram intactos após a injeção, 31 foram fertilizados e 15 desenvolveram embriões que poderiam ser transferidos para o útero.
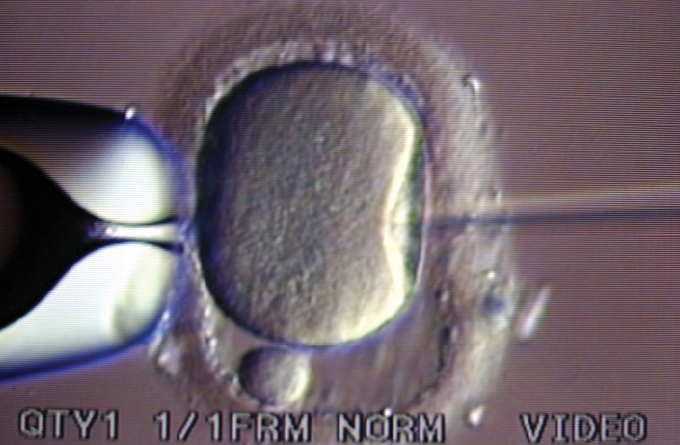
No final das contas, quatro bebês nasceram: dois meninos saudáveis de duas gestações únicas e um par saudável de gêmeos menino e menina. Os cientistas belgas chamaram o procedimento de ICSI (pronuncia-se ICK-see), uma abreviação para injeção intracitoplasmática de esperma.
Hoje, injetar um único espermatozóide diretamente em um óvulo é ainda mais comum do que a forma tradicional de fertilização in vitro que adiciona espermatozoides a um óvulo em uma placa de laboratório para permitir que a fertilização aconteça por conta própria. O método de injeção é usado em cerca de dois terços dos ciclos de ART em todo o mundo. E é usado em praticamente todos os ciclos que, como o de Claudy, começam com um ovo congelado de casca dura.
Criando um bebê saudável
Em 2018, Claudy retorna à clínica de fertilidade do Hospital Universitário Antoine Béclère, no subúrbio de Paris. Ela tem 34 anos e não tem câncer. Devido à natureza incomum de seu caso – seus óvulos eram imaturos quando foram retirados e amadurecidos no laboratório – seus médicos não estão confiantes de que os óvulos sobreviverão ao descongelamento e manipulações subsequentes.
Todos os seis ovos de Claudy descongelam sem danos aparentes. Os cientistas realizam ICSI nos óvulos, usando esperma fresco do parceiro de Claudy. Cinco dos ovos fertilizam.
Esses cinco zigotos vão para uma incubadora para que possam se desenvolver até um estágio de implantação. Eles passam pelos estágios iniciais de clivagem, em que uma célula se torna duas, duas se transformam em quatro, quatro se transformam em oito e assim por diante.
Em muitas clínicas de fertilidade em outras partes do mundo, os médicos podem interromper as coisas neste ponto para cortar uma ou duas células do embrião inicial para ver se as coisas estão progredindo normalmente. Foi revolucionário descobrir que isso poderia até ser feito – uma façanha realizada pela primeira vez em 1968 pelo embriologista Richard Gardner. Na época, Gardner era um estudante graduado que trabalhava no laboratório de Edwards em Cambridge. Seu trabalho mostrou pela primeira vez que era possível em coelhos obter células de um blastocisto sem causar danos.
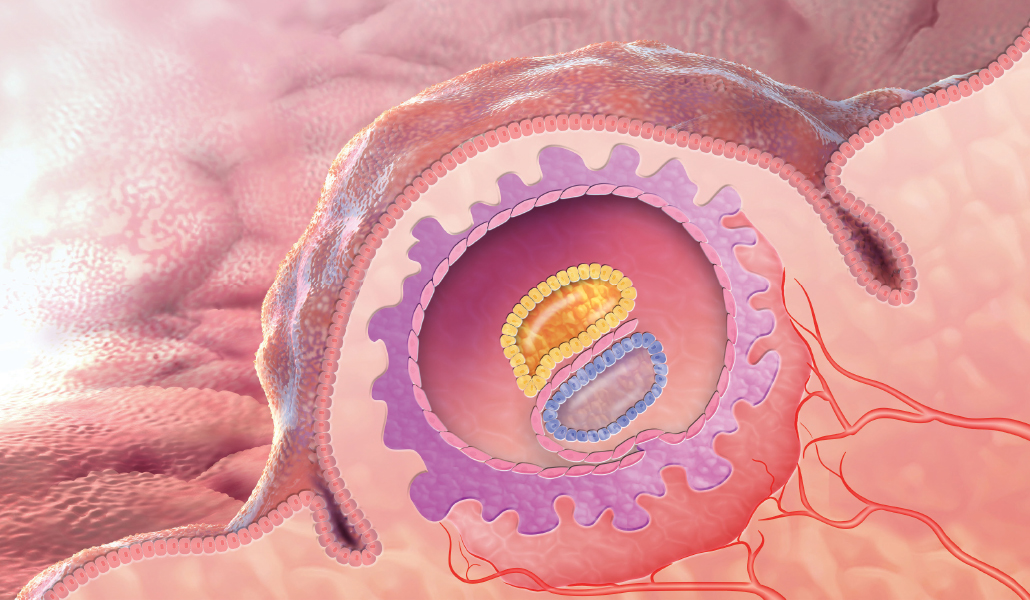
Os cientistas podem examinar os cromossomos dessas células removidas de um embrião humano, um processo chamado diagnóstico genético pré-implantação, ou PGD. Eles podem estar procurando por um determinado gene ligado a uma doença que é familiar, para evitar a implantação de um embrião afetado no útero. Ou eles podem estar verificando se um embrião em desenvolvimento tem o número certo de cromossomos e se o embrião tem uma boa chance de se implantar no útero e nascer um bebê com 10 dedos das mãos, 10 dedos dos pés e a chance de uma vida saudável.
No futuro, eles também podem usar o PGD para ver se um ajuste de gene desejado, introduzido por meio de uma técnica de edição de genes como o CRISPR, realmente funcionou. Sem PGD, nenhuma dessas abordagens, desde a prevenção de doenças até bebês projetados, poderia ocorrer.
Dois dias depois de colocar os cinco embriões de Claudy na incubadora, apenas um ainda está em clivagem. Esse é o embrião que os médicos transferem para o útero de Claudy no outono de 2018.
O embrião se implanta e continua a se desenvolver como qualquer embrião faria, não importa qual seja sua história de origem – uma bola de algumas centenas de células embrionárias geneticamente idênticas que eventualmente se diferenciam em cerca de 200 tipos de células que constituem um ser humano. O mecanismo pelo qual isso ocorre foi estabelecido pela primeira vez em 1924 pelo investigador alemão Hans Spemann, que descobriu o “efeito organizador” que leva regiões específicas do embrião a se desenvolverem em tipos de células específicos.
Em 1965, Beatrice Mintz criou ratos que usavam sua bizarra linhagem genética em seus casacos listrados em preto e branco. Em seu laboratório no Institute for Cancer Research, na Filadélfia, ela criou um camundongo com quatro pais – duas mães e dois pais – para demonstrar qual contribuição genética dos pais acabou em qual região do corpo.

Mintz fundiu embriões de oito células de dois camundongos diferentes, um embrião preto puro e um branco puro, colocando-os em uma placa de laboratório, dissolvendo a camada protetora ao redor de cada embrião e, na verdade, comprimindo-os juntos usando uma vareta de vidro. O resultado foi um camundongo mosaico: algumas de suas células continham genes que podiam ser rastreados diretamente até os pais dos dois camundongos brancos, e algumas tinham genes dos dois pais do camundongo preto.
Outros mistérios de como os embriões se desenvolvem foram revelados pela tecnologia de “nocaute”, na qual os cientistas desativaram genes em uma região específica de um embrião para ver o que esses genes controlavam. Em 1995, os biólogos do desenvolvimento William Shawlot e Richard Behringer, do MD Anderson Cancer Center da Universidade do Texas, em Houston, relataram o uso desse método em embriões de camundongo, confirmando a teoria de Spemann de que uma pequena região do embrião provoca mudanças nas células vizinhas para transformá-las em particular tipos de células.
O embrião no útero de Claudy se desenvolve normalmente; tudo sobre sua gravidez parece normal – exceto quão milagroso pode parecer para a própria Claudy, que deve ter tido algumas dúvidas, como uma jovem paciente com câncer de mama, sobre se ela algum dia teria um filho. No início de julho de 2019, Claudy volta ao Hospital Universitário Antoine Béclère, desta vez para dar à luz. Seu filho nasceu em 6 de julho; ela e seu parceiro o chamam de Jules.
Quando Grynberg pede permissão a Claudy para escrever seu caso marcante nos Annals of Oncology, ela fica maravilhada. “Pensei em tudo o que havia passado”, disse ela a um repórter do jornal britânico The Telegraph, enquanto posava para uma foto com o bebê Jules. “E eu chorei ao perceber o quão sortudo eu era.”
Publicado em 13/06/2021 13h11
Artigo original:


